
科目: 来源: 题型:
下列实验方法正确的是 ( )
A.用渗析的方法精制氢氧化铁胶体
B.加入适量NaOH溶液后过滤,以除去KCl溶液中少量的MgCl2
C.测定溶液pH,用玻璃棒蘸取原溶液点在润湿的pH试纸上立即与比色卡比较
D.测定硫酸铜晶体中结晶水含量,实验过程中至少需要三次称量
查看答案和解析>>
科目: 来源: 题型:
判断下列有关化学基本概念的依据正确的是( )
A.氧化还原反应:元素化合价是否变化
B.共价化合物:是否含有共价键
C.强弱电解质:溶液的导电能力大小
D.金属晶体:晶体是否能够导电
查看答案和解析>>
科目: 来源: 题型:
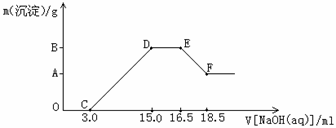
硝酸跟金属反应时,随着硝酸的浓度下降和金属活动性的增大,产物中氮元素的化合价会逐渐下降,它们可能是NO2、NO、N2O、N2或NH3中的一种或几种。现有一定量铁粉和铝粉组成的混合物跟100ml稀硝酸充分反应,反应过程中无任何气体放出,在反应结束后的澄清溶液中,逐渐加入4.00mol/L的氢氧化钠溶液,加入氢氧化钠溶液的体积与产生沉淀的质量如图所示:
请回答:
(1)反应后的溶液中加入NaOH的溶液没有立即出现沉淀的原因是:________________。
(2)跟硝酸反应后的产物中铁元素的化合价是__________。
(3)图形中DEF先平后下折的原因是_________________________________________。
(4)纵坐标中A点的数值是________________。原稀硝酸的浓度是______________。
查看答案和解析>>
科目: 来源: 题型:
合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。
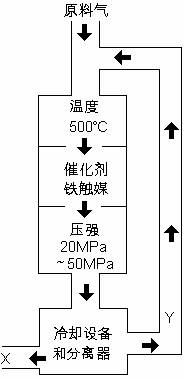
(1)X的化学式为____________;
(2)图中条件选定的主要原因是(选填字母序号)_________
A.温度、压强对化学平衡影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
(3)改变反应条件,会使平衡发生移动。下图表示随条件改变,氨气的百分含量的变化趋势。
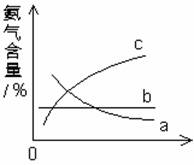
当横坐标为压强时,变化趋势正确的是(选填字母序号)____________,当横坐标为温度时,变化趋势正确的是(选填字母)__________。
(4)常温下氨气极易溶于水,其水溶液可以导电。
①用化学方程式表示氨气溶于水的过程中存在的可逆反应___________________。
②氨水中水电离出的c (OH―)__________10―7mol/L(填“>”、“<”或“=”)。
(5)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A和B两种物质。A为铵盐,B在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96L氨气(标准状况),同时生成0.3mol A。写出氨气和氟气反应的化学方程式__________________________________
查看答案和解析>>
科目: 来源: 题型:
在一定条件下可实现如图所示物质之间的变化,其中甲、乙为金属单质,丙、丁、戊为非金属单质,B为氧化物。
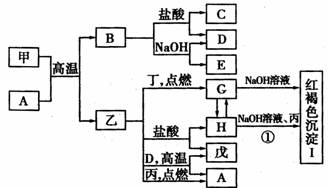
请填写下列空白:
(1)物质A的化学式是____________,乙在元素周期表中的位置是____________。
(2)甲与NaOH溶液反应的离子方程式是___________ ___________。
描述反应①发生的现象是_____________________。
(3)乙在丙、D同时存在的条件下,可发生电化学腐蚀,写出正极上的电极反应式
_________________________________________________________________
查看答案和解析>>
科目: 来源: 题型:
某溶液由Na+ 、Cu2+ 、Fe3+、AlO2- 、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:
(1)向其中加入过量盐酸,有气体生成,并得到无色透明溶液;
(2)在(1)所得溶液中加入过量氨水,产生白色沉淀,过滤;
(3)在(2)所得的滤液中加入过量氢氧化钡溶液,产生白色沉淀,过滤;
(4)在(3)所得滤液中加入过量的稀硝酸,再加入硝酸银溶液,产生白色沉淀。
根据上述操作回答下列问题:
(1)原溶液中肯定存在的离子是_______________;
(2)原溶液中可能存在的离子是_______________;
(3)原溶液中肯定不存在的离子是________________。
查看答案和解析>>
科目: 来源: 题型:
酸碱中和滴定的实验
(1)实验中需配制0.20mol?L-1的NaOH溶液500ml,用到的仪器是:天平(含砝码)、烧杯、药匙、玻璃棒、胶头滴管和 。
(2)用酸式滴定管准确量取25.00mL未知浓度的盐酸溶液于一洁净的锥形瓶中,然后用0.20mol?L-1的NaOH溶液滴定,指示剂用酚酞。滴定结果如下:
| NaOH 溶液起始读数/mL | NaOH 溶液终点读数/mL | |
| 第一次 | 0.20 | 18.75 |
| 第二次 | 0.50 | 19.10 |
①根据以上数据可以计算出盐酸溶液物质的量浓度为____________mol•L-1(保留四位有效数字)。
②达到滴定终点的标志是_________________。
(3)用已知浓度的氢氧化钠溶液滴定未知浓度的盐酸溶液,滴定过程中进行如下操作,分别指出各项操作对所测定盐酸溶液物质的量浓度的影响(填“偏高”、“偏低”、“无影响”)。
①滴定前,滴定管尖嘴处有气泡,滴定后气泡消失。________________。
②滴定前,锥形瓶用蒸馏水洗涤后,未用待测的盐酸溶液润洗就做滴定。___________。
③滴定完毕,滴定管读数时,俯视记终点。_________________。
查看答案和解析>>
科目: 来源: 题型:
某校研究性学习小组的同学对金属镁在空气中燃烧的产物进行探究。
(1)甲同学认为,空气中存在大量的氮气,镁可能和氮气反应。他设计了如下装置进行实验:

镁条燃烧完后取出蒸发皿观察,发现蒸发皿中除有白色固体外还有少量的淡黄色固体。能支持甲同学观点的实验现象除生成淡黄色固体外,还有的现象是__________________,理由是_________________________________________;
(2)乙同学对甲同学实验中生成的淡黄色固体产生了兴趣,他向蒸发皿中的固体滴加少量水,发现有刺激性气味的气体产生,淡黄色固体转变成白色。请你写出上述过程中发生的化学反应方程式:_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com