
科目: 来源: 题型:

A.只有①和②处 B.只有②处 C.只有②和③处 D.只有②③④处
查看答案和解析>>
科目: 来源: 题型:
实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
Ⅰ | 7.4 | 40.00 | 1.68 |
Ⅱ | 14.8 | 40.00 | 3.36 |
Ⅲ | 22.2 | 40.00 | 1.12 |
Ⅳ | 37.0 | 40.00 | 0.00 |
(1)实验过程中有关反应的离子方程式为:________________________________。
(2)由Ⅰ组数据直接推测:标准状况下用3.7 g样品进行同样实验时,生成氨气的体积为________L。
(3)试计算该混合物中的(NH4)2SO4和NH4HSO4物质的量之比________。
(4)欲计算该NaOH溶液的物质的量浓度,应选择第________组数据,由此求得NaOH溶液的物质的量浓度为________。
查看答案和解析>>
科目: 来源: 题型:
(1)该黄铁矿中FeS2的质量分数为多少?
(2)该工厂用这种黄铁矿制硫酸,在FeS2燃烧过程中损失2%,由SO2氧化成SO3时,SO2的利用率为80%。求该工厂用10.0 t这种黄铁矿可生产98%的硫酸多少吨?
查看答案和解析>>
科目: 来源: 题型:
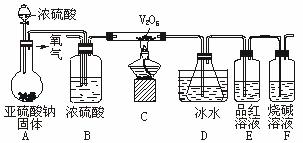
(1)装置B的三个作用是:①________;②________;③________。
(2)实验过程中,当V2O5表面红热后,应将酒精灯移开一会儿后再继续加热,其原因是___________________________________________________。
(3)反应停止后,要通过装置D锥形瓶中产生的白色沉淀的量测定已被氧化的二氧化硫的量时,在滤出沉淀前必须进行的一步实验操作是(简述过程)_______________________
_________________________________________。
D中锥形瓶盛放的溶液可以是(选填序号)________。
a.足量澄清石灰水 b.足量小苏打溶液
c.足量氯化钡溶液 d.足量硝酸钡溶液
(4)若从锥形瓶溶液中得到的沉淀质量为W g,要测定该条件下二氧化硫的转化率,实验时还需要测定的数据是(选填序号)________。
a.装置F增加的质量(a g) b.装置A中亚硫酸钠减少的质量(b g)
c.装置B增加的质量(c g) d.装置E增加的质量(d g)
则此条件下二氧化硫的转化率是(填写计算式)_____________。
查看答案和解析>>
科目: 来源: 题型:
| B | E | F |
起始组成/mol | 2 | 4 | 0 |
某时刻组成/mol | 1 | 2 | 2 |
(1)写出反应①的离子方程式:________。
写出反应②的化学方程式:________。
(2)工业上提高E转化成F的转化率的措施是__________________________________。
工业上吸收F的方法是______________________________________________________。
查看答案和解析>>
科目: 来源: 题型:

(1)写出化学式:A_________、B_________、C_________、D_________、E_________。
(2)写出化学方程式:①______________________________,③____________________,⑤_________________________。
(3)写出离子方程式:②________________,④__________________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)写出由磷灰石制取过磷酸钙的化学方程:___________________________________。
(2)写出在某一地区宜兴建一个大型磷肥厂的三条必要条件:
①_________________________________________________________________________
②_________________________________________________________________________
③_________________________________________________________________________
查看答案和解析>>
科目: 来源: 题型:
(1)在生产中常用过量的空气是为了__________________________________________。
(2)加热到400~500 ℃是由于______________________________________________。
(3)压强采用__________,原因是_____________________________________________。
(4)尾气中的SO2必须回收,是为了_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
A.![]() mol B.
mol B.![]() mol C.
mol C.![]() mol D.
mol D.![]() mol
mol
查看答案和解析>>
科目: 来源: 题型:
SO2(g)+![]() O2(g)
O2(g)![]() SO3(g);
SO3(g);
ΔH=-![]() kJ·mol-1
kJ·mol-1
测得SO2的转化率为90%,则在此条件下反应放出的热量(kJ)为
A.0.9 Q B.Q C![]() Q D.0.45 Q
Q D.0.45 Q
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com