
科目: 来源: 题型:
用浓硫酸配制一定物质的量浓度的硫酸溶液,下列操作会造成所配溶液浓度偏高的是
A.溶解后的溶液未冷却至室温就转移入容量瓶中
B.反复倒转摇匀后,液面低于刻度线,再加蒸馏水至液面最低点恰好与刻度线相平
C.洗涤烧杯和玻璃棒的溶液转移入容量瓶中
D.定容时,眼睛仰视刻度线
查看答案和解析>>
科目: 来源: 题型:
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的HCl溶液、CuSO4溶液和K2SO4溶液,电极均为石墨电极。
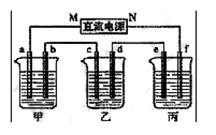
(1)接通电源后,观察到甲中b电极上产生刺激性气味气体。据此回答问题:
① 电源的N端为_____ 极;
② 电极c上的现象为_____________________________;
③ 电极f上的电极反应式为__________________________________;
④ 乙中加入_______________________,可使其恢复至原溶液。
(2)若丙中盛装19g质量分数为10%的K2SO4溶液,当电极b上产生的刺激性气味气体在标准状况下的体积为11.2L时,则丙中质量分数变为:_________________;(过程中无晶体析出)
(3)如果乙装置电解过程中铜全部析出,此时电解能否继续进行,_______________。为什么?
查看答案和解析>>
科目: 来源: 题型:
诺贝尔化学奖获得者Gerhard Ertl在表面化学研究领域取得了开拓性成就。某反应在Pt/Al2O3/Ba催化剂表面吸附与解吸作用的机理如图所示(图中HC表示碳氢化合物,nitrate指硝酸盐),该机理研究是指( )
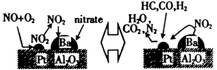
A. 汽车尾气催化转化机理
B. 钢铁生锈机理
C. 合成氨工业催化机理
D. 氢氧燃烧电池电极反应机理
查看答案和解析>>
科目: 来源: 题型:
100℃时,KCl溶液中溶质的质量分数为ω1。降至室温后析出m g KCl晶体(晶体中不含结晶水),所得溶液中溶质的质量分数为ω2,则下列说法不正确的是
A.KCl的溶解度随温度的升高而升高
B.溶液中KCl的质量分数ω1一定大于ω2
C.降温前后,KCl溶液都是饱和溶液
D.由题中已知条件,都无法计算出降温前后的溶液物质的量浓度
查看答案和解析>>
科目: 来源: 题型:
只用一种试剂可区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3四种溶液,这种试剂是( )
A.Ba(NO3)2 B.H2SO4 C.NaOH D.AgNO3
查看答案和解析>>
科目: 来源: 题型:
将钠、镁、铝各0.3mol分别放入100mL的1mol/L的盐酸中充分反应,生成的气体在同温、同压下的体积比是( )
A.1:2:3 B.6:3:2 C.3:1:1 D.1:1:1
查看答案和解析>>
科目: 来源: 题型:
按下图装置进行电解(均是惰性电极),已知A烧杯中装有500 mL20%的NaOH溶液,B烧杯中装有500 mL pH为6的1 mol·L-1CuSO4溶液。通电一段时间后,在b电极上收集到28mL气体(标准状况),则B烧杯中溶液pH变为(溶液体积变化忽略不计)
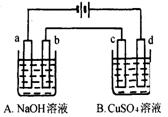
A.4 B.3 C.2 D.1
查看答案和解析>>
科目: 来源: 题型:
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
制备纳米TiO2的方法之一是TiCl4水解生成TiO2·x H2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2 。
用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+ ,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
⑴ TiCl4水解生成TiO2·x H2O的化学方程式为__________________________。
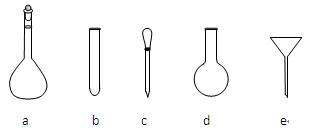
(2) 配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是____________;
使用的仪器除天平、药匙、玻璃棒、烧杯、量简外,还需要下图中的_____(填字母代号)。
(3) 滴定终点的现象是____________________________________________。
(4) 滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为______________________。
(5) 判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
① 若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果_________________。
② 若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果_____。
查看答案和解析>>
科目: 来源: 题型:
A、B、C、D、E五种短周期元素,原子序数依次增大,其中只有C为金属元素。A、C原子序数之和等于E的原子序数,D与B同主族且D原子序数是B原子序数的2倍。AB2和DB2溶于水得到酸性溶液,C2D溶于水得到碱性溶液。
(1)E元素在周期表中的位置为 ;工业上制取C单质的化学方程式为 。
(2)A的最低负价氢化物的空间构型为 ;C、D、E的简单离子的离子半径由大到小的顺序是 (用离子符号表示)。
(3)在低温下,将E的单质通人饱和NaHCO3溶液中,反应后得到一种微绿色气体易E2B、CE和另外一种无色气体。则该反应中E2B、CE这两种产物的物质的量之比
n(E2B):n(CE)= 。已知E2B溶于水生成一种具有漂白性的弱酸,该弱酸分子的结构式为 。
(4)化合物C2 D3中,各原子(或离子)最外层均达到8电子稳定结构,则C2D3的电子式为 ,该化合物的水溶液在空气中久置后变质,生成一种单质,所得溶液呈强碱性,用化学方程式表示这一变化过程 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com