
科目: 来源:2012-2013学年江苏省扬州市高三第一学期检测试卷化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W的原子序数依次增大,元素X的原子半径最小,Y 元素和X元素在一定条件下能形成YX,Z和W的原子序数相差8,W原子的电子总数是其电子层数的5倍。下列叙述正确的是
A.Y可用于制造高性能可充电电池
B.WX3的沸点高于ZX3
C.Z的最高价含氧酸的酸性强于W的最高价含氧酸的酸性
D.原子半径的大小顺序:rW>rZ>rY>rX
查看答案和解析>>
科目: 来源:2012-2013学年江苏省扬州市高三第一学期检测试卷化学试卷(解析版) 题型:选择题
下列根据实验操作和现象所得出的结论不正确的是
选项 实验操作 实验现象 结论
A 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 2 min后,试管里出现凝胶 酸性:盐酸>硅酸
B 在酒精灯上加热铝箔 铝箔熔化但不滴落 熔点:氧化铝>铝
C 常温下,向浓硫酸中投入铁片 铁片不溶解 常温下,铁不与浓硫酸反应
D 向某溶液中先滴加KSCN溶液,再滴加少量氯水 先无明显现象,后溶液变成血红色 溶液中含有Fe2+,没有Fe3+
查看答案和解析>>
科目: 来源:2012-2013学年江苏省扬州市高三第一学期检测试卷化学试卷(解析版) 题型:选择题
常温下,向10 mL 0.1 mol·L-1的H2C2O4溶液中逐滴加入0.1 mol·L-1 KOH溶液,所得滴定曲线如图所示。下列说法正确的是

A.KHC2O4溶液呈弱碱性
B.B点时:c(K+)>c(HC2O4-)>c(H+)>c(OH-)
C.C点时:c(HC2O4-)+c(C2O42-)+c(H2C2O4)<c(K+)<
c(HC2O4-)+2c(C2O42-)+c(H2C2O4)
D.D点时:c(H+)+ c(HC2O4-)+ c(H2C2O4)= c(OH-)
查看答案和解析>>
科目: 来源:2012-2013学年江苏省扬州市高三第一学期检测试卷化学试卷(解析版) 题型:选择题
在温度、容积相同的2个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
(已知N2(g)+3H2(g)
 2NH3(g) △H=-92.4 kJ·mol-1)
2NH3(g) △H=-92.4 kJ·mol-1)
|
容器 |
甲 |
乙 |
|
反应物投入量 |
1 mol N2、3 mol H2 |
4 mol NH3 |
|
NH3的浓度(mol·L-1) |
c1 |
c2 |
|
反应的能量变化 |
放出a kJ |
吸收b kJ |
|
气体密度 |
ρ1 |
ρ2 |
|
反应物转化率 |
α1 |
α2 |
下列说法正确的是
A.c1<c2<2 c1 B.a+b>92.4 C.α1 +α2=1 D.ρ2=2ρ1
查看答案和解析>>
科目: 来源:2012-2013学年江苏省扬州市高三第一学期检测试卷化学试卷(解析版) 题型:填空题
多晶硅生产工艺流程如下:
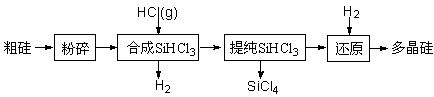
(1)粗硅粉碎的目的是 。分离SiHCl3 (l)和SiCl4(l)的方法为 。
(2)900℃以上, H2与SiHCl3发生如下反应:SiHCl3
(g)+ H2 (g)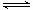 Si
(s) + 3HCl (g) ΔH >0,其平衡常数表达式为K = 。为提高还原时SiHCl3的转化率,可采取的措施有
。
Si
(s) + 3HCl (g) ΔH >0,其平衡常数表达式为K = 。为提高还原时SiHCl3的转化率,可采取的措施有
。
(3)该流程中可以循环使用的物质是 。
(4)SiCl4与上述流程中的单质发生化合反应,可以制得SiHCl3,其化学方程式为 。
查看答案和解析>>
科目: 来源:2012-2013学年江苏省扬州市高三第一学期检测试卷化学试卷(解析版) 题型:实验题
硼镁矿属于硼酸盐,可用来制备硼酸(H3BO3)和MgO,方法如下:硼镁矿粉与(NH4)2SO4溶液混合后加热,反应生成H3BO3晶体和MgSO4溶液,同时放出NH3;再向MgSO4溶液中通入NH3与CO2,得到MgCO3沉淀和滤液,沉淀经洗涤、煅烧后得MgO,滤液则循环使用。回答下列问题:
(1)与硅酸盐类似,硼酸盐结构也比较复杂,如硬硼钙石化学式为Ca2B6O11·5H2O,将其改写为氧化物的形式 。
(2)上述制备过程中,检验沉淀洗涤是否完全的方法是 。
(3)写出MgSO4溶液中通入NH3与CO2反应的化学方程式 。
(4)若准确称取1.68 g硼镁矿,完全反应后得H3BO3晶体1.24 g,MgO 0.8 g,计算该硼酸盐的组成。(写出计算过程)
查看答案和解析>>
科目: 来源:2012-2013学年江苏省扬州市高三第一学期检测试卷化学试卷(解析版) 题型:实验题
以钡矿粉(主要成份为BaCO3,含有Ca2+、Fe2+、Fe3+、Mg2+等)制备BaCl2·2H2O的流程如下:

(1)氧化过程主要反应的离子方程式为 。
(2)沉淀C的主要成分是Ca(OH)2和 。由图可知,为了更好的使Ca2+沉淀,还应采取的措施为 。


(3)用BaSO4重量法测定产品纯度的步骤为:
步骤1:准确称取0.4~0.6 g BaCl2·2H2O试样,加入100 ml 水,3 ml 2 mol·L-1 的HCl溶液加热溶解。
步骤2:边搅拌,边逐滴加入0.1 mol·L-1 H2SO4溶液。
步骤3:待BaSO4沉降后, ,确认已完全沉淀。
步骤4:过滤,用0.01 mol·L-1的稀H2SO4洗涤沉淀3~4次,直至洗涤液中不含Cl-为止。
步骤5:将折叠的沉淀滤纸包置于 中,经烘干、炭化、灰化后在800℃灼烧至恒重。称量计算BaCl2·2H2O中Ba2+的含量。
①步骤3所缺的操作为 。
②若步骤1称量的样品过少,则在步骤4洗涤时可能造成的影响为 。
③步骤5所用瓷质仪器名称为 。滤纸灰化时空气要充足,否则BaSO4易被残留的炭还原生成BaS,该反应的化学方程式为 。
④有同学认为用K2CrO4代替H2SO4作沉淀剂效果更好,请说明原因 。
[已知:Ksp(BaSO4)=1.1×10-10 Ksp(BaCrO4)=1.2×10-10]
查看答案和解析>>
科目: 来源:2012-2013学年江苏省扬州市高三第一学期检测试卷化学试卷(解析版) 题型:简答题
氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等。
(1)已知:N2(g)+2H2(g)=N2H4(l) △H= + 50.6kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
则①N2H4(l)+O2(g)=N2(g)+2H2O(l) △H= kJ·mol-1
②N2(g)+2H2(g)=N2H4(l) 不能自发进行的原因是 。
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是 。
(2)采矿废液中的CN- 可用H2O2处理。已知:H2SO4=H++ HSO4-
HSO4-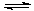 H++ SO42-
H++ SO42-
用铂电极电解硫酸氢钾溶液,在阳极上生成S2O82-,S2O82-水解可以得到H2O2。写出阳极上的电极反应式 。
(3)氧化镁处理含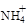 的废水会发生如下反应:
的废水会发生如下反应:
MgO+H2O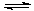 Mg(OH)2 Mg(OH)2+2NH4+
Mg(OH)2 Mg(OH)2+2NH4+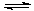 Mg2+ +2NH3·H2O。
Mg2+ +2NH3·H2O。
①温度对氮处理率的影响如图所示。在25℃前,升高温度氮去除率增大的原因是 。

②剩余的氧化镁,不会对废水形成二次污染,理由是 。
(4)滴定法测废水中的氨氮含量(氨氮以游离氨或铵盐形式存在于水中)步骤如下:①取10 mL废水水样于蒸馏烧瓶中,再加蒸馏水至总体积为175 mL②先将水样调至中性,再加入氧化镁使水样呈微碱性,加热③用25 mL硼酸吸收蒸馏出的氨[2NH3+4H3BO3=(NH4)2B4O7+5H2O]④将吸收液移至锥形瓶中,加入2滴指示剂,用c mol·L-1的硫酸滴定至终点[(NH4)2B4O7+H2SO4+5H2O=(NH4)2SO4+4H3BO3],记录消耗的体积V mL。则水样中氮的含量是 mg·L-1(用含c、V的表达式表示)。
查看答案和解析>>
科目: 来源:2012-2013学年江苏省扬州市高三第一学期检测试卷化学试卷(解析版) 题型:填空题
硫元素可以形成多种物质如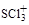 、SO2、SO32-、SO42-等。
、SO2、SO32-、SO42-等。
(1)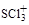 中S原子的轨道杂化类型是
,
中S原子的轨道杂化类型是
,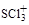 的空间构型是 。
的空间构型是 。
(2)向[Cu(NH3)4]SO4溶液中通入SO2至微酸性,有白色沉淀生成。分析表明该沉淀中Cu、S、N的物质的量之比为1:1:1,经测定该沉淀的晶体里有一种三角锥型的阴离子和一种正四面体型的阳离子。
①[Cu(NH3)4]SO4中Cu2+的电子排布式为 。
②[Cu(NH3)4]SO4中存在的化学键类型有 (填序号)。
A.共价键 B.氢键 C.离子键 D.配位键 E.分子间作用力
③写出与SO42-互为等电子体的一种分子 。上述白色沉淀的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com