
科目: 来源: 题型:
【题目】碳酸钡广泛用于陶瓷、光学玻璃等行业。有一种碳酸盐矿石,其主要成分是碳酸钡和碳酸钙,现以此矿石为原料生产碳酸钡,并得到副产品氢氧化钙,其流程如下图所示:
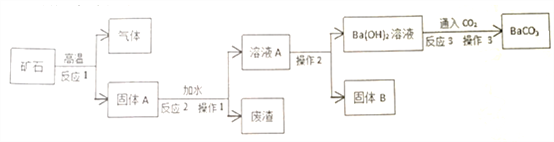
已知,氢氧化钡和氢氧化钙在不同温度下的溶解度是:
温度/℃ | 0 | 40 | 80 |
氢氧化钡溶解度/g | 1.67 | 8.22 | 101.4 |
氢氧化钙溶解度/g | 0.187 | 0.141 | 0.094 |
请回答
(1)碳酸钡与碳酸钙的化学性质相似,高温下能分解成两种氧化物,碳酸钡在高温下分解的化学方程式为______________。
(2)氧化钡与氧化钙的化学性质相似,能与水反应。溶液A中存在的阳离子是___________(写离子符号)。
(3)在实验室里完成操作1,需要用到的玻璃仪器除漏斗、玻璃棒外,还有______________。
(4)操作2采用的操作方法依次为____________(填序号)。
A.过滤 B.降温 C.加热 D.蒸馏 E.灼烧
(5)反应3的化学方程式为___________________________________________。
(6)废渣要经过洗涤后才能弃渣,原因是________________________。
(7)假设该碳酸盐矿石中含有40%的碳酸钙,那么50kg该矿石理论上可制得氢氧化钙的质量是________kg。
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究影响氯酸钾分解速率的因素,小红同学把实验温度恒定在330℃或380℃,(其他实验条件见下表),并设计了以下实验。
实验编号 | 氯酸钾的质量 | 其他物质的质量∕g | 温度∕℃ | 收集氧气的体积/mL | 反应所需时间∕s |
① | 2.0 | 330 | 100 | t1 | |
② | 2.0 | CuO 0.5 | 330 | 100 | t2 |
③ | 2.0 | MnO2 0.5 | 330 | 100 | t3 |
④ | 2.0 | MnO2 ____ | _______ | 100 | t4 |
请回答
(1)进行实验②和③,并对对比,其实验目的是____________________。
(2)要说明氧化铜对氯酸钾分解速率的影响,则要选用实验______和实验_______进行对比。
(3)用实验③和④探究温度对氯酸钾分解速率的影响,则MnO2的质量是__________g,反应的温度是_________℃,实验④发生反应的化学方程式为___________________;若t3>t4,氯酸钾分解速率与温度的关系是__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学实验中经常用到一定溶质质量分数的溶液。
(1)实验室配制质量分数为4%的氯化钠溶液50g
①需要固体氯化钠的质量_____________g,水___________mL(水的密度1g∕cm3)
②用托盘天平称量所需的氯化钠钠时,移动好游码,向托盘中加入氯化钠,若指针偏向分度盘的左边,要进行的操作是_____________________。
(2)若用质量分数为6%的氯化钠溶液液(密密度约为1.04g/cm3)配制50g质量分数为3%的氯化钠溶液。
①需要6%的氯化钠溶液_________mL(计算结果保留一位小数),水________g。
②该溶液配制过程中除用到量筒、玻璃棒和烧杯外,还需要的仪器是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】请根据下列实验装置回答问题:
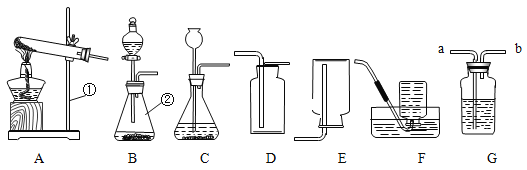
(1)写出仪器①②的名称:①__________________;②_____________________。
(2)用高锰酸钾制取氧气的化学方程式为________________________________;当用F装置收集满O2并取出集气瓶后,停止该实验的正确操作方法是________________。
(3)可用E装置收集的气体是________________(需答两种)。
(4)硫化氢(H2S)是有毒气体,实验室常用块状硫化亚铁(FeS)和稀硫酸在常温下反应制取硫化氢(H2S)气体,应选用的发生装置最好是_________________。
(5)检査C装置气密性的方法是:先用弹簧夹夹住导气管上的胶皮管,再向长颈漏斗中 加入水_______________________,静置,若观察到________________,说明气密性良好。
(6)G装置可用于气体的收集、检验、除杂和体积的测量等,用该装置不能完成的实验是______________(填序号)。
A.气体从a端通入,收集氢气。
B.瓶内装有澄清石灰水,气体从a端通入,检验氧气中中是否混有二氧化碳。
C.在b端连接量筒,瓶内装满水,氧气从a端通入,测量气体的体积。
D.瓶内装有氢氧化钠溶液,气体从a端通入,吸收一氧化碳中混有的二氧化碳。
查看答案和解析>>
科目: 来源: 题型:
【题目】在盛有少量稀盐酸的烧杯中加入足量的碳酸镁固体至恰好完全反应。请回答:
(1)上述反应中的实验现象为___________________________。
(2)下图表示加入碳酸镁固体前后溶液中存在的主要离子,写出每种图形代表的离子
(写离子符号)。
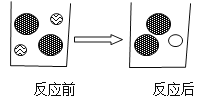
![]() __________,
__________,![]() __________,
__________,![]() ____________。
____________。
(3)下列物质中能与盐酸反应,而且反应前后溶液中的离子种类和个数比变化与上图相似的是_________________(填序号)。
A.CuO粉末 B.KOH溶液 C.BaCO3固体 D.Cu片
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙、丙三种固体物质的溶解度曲线如图所示,回答下列问题:
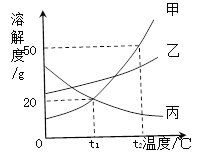
(1)气体的溶解度随温度变化的情况与________(填“甲”、“乙”或“丙”)相似。
(2) t2℃时,将65g甲固体加入到100g水中,充分溶解并恢复到原温度后,得到溶液的质量为________g。
(3)要使t2℃时接近饱和的丙溶液变成该温度下的饱和溶液,可采用的一种方法是___________。
(4)若将t2℃时甲的饱和溶液降温到t1℃,则其溶液的溶质质量分数会_________(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】高纯铊(Tl)及其合金可做半导体材料。已知硫酸亚铊(T12SO4)溶液为无色,氢氧化亚铊(T1OH)溶液显黄色;用硫酸亚铊溶液可制得氢氧化亚铊,氢氧化亚铊加热分解生成氧化亚铊(T12O)和水,氧化亚铊与氢气加热得到铊。
(1)铊元素的化合价有+1、+3价,写出氧化铊的化学式_________________。
(2)取少量无色硫酸亚铊溶液于试管中,再滴加适量氢氧化钡溶液,充分振荡、静置,观察到的实验现象是_________,反应的化学方程式为________________。
(3)氢氧化亚铊加热分解的化学方程式为________________。
(4)氧化亚铊与氢气加热生成铊和水,该反应属属于______________(填反应类型)。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属材料在生产、生活中应用广泛。
(1)图A、B、C是金属属的应用实例,根据这些实例可推断出金属具有的物理性质有____________(需答两点)。

(2)图D中,最容易生锈的部位是___________(填“a”“b”或“c”)。
(3)焊锡(主要含锡、铅)与其组成它的纯金属相比具有_______________的特性,可用来焊接金属。
(4)将纯铜片和黄铜片互相刻画画,纯铜片上留下明显的划痕(实验如图E所示),该实验说明了________________________________.
(5)用磁铁矿(Fe3O4)炼铁的原理是:在高温下,用一氧化碳把铁从磁铁矿里还原出来,该反应的化学方程式为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】能源利用和环境保护是人类共同关注的问题。
(1)石油是一种粘稠状液体,主要含有_____________两种元素
(2)页岩气是指蕴藏于页岩系统中的天然气,页岩气主要成分完全燃烧的化学方程式为___________。
(3)某电厂为防止环境污染,用石灰石粉浆来吸收煤燃烧时排放出的二氧化硫,其反应的化学方程式为:2CaCO3+2SO2+O2==2CaSO4+2X,则X的化学式为_________。
(4)以天然气为燃料的燃气灶,当其火焰呈现黄色或橙色,锅底出现黑色,这时就需要调节灶具的进风口,目的是_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】阿司匹林是治疗心血管病的重要药物之一,其主要成分是乙酰水杨酸(化学式为C9H8O4)。下列关于乙酰水杨酸的说法正确的是
A. 乙酰水杨酸分子中,碳原原子、氢原子和氧原子的原子个数比是12:1:16
B. 乙酰水杨酸中,碳元素与氧元素的质量比为9:8
C. 45g乙酰水杨酸中氢元素的质量是2g
D. 乙酰水杨酸中,氧元素的质量分数为![]() ×100%
×100%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com