
科目: 来源: 题型:
【题目】如图所示,小文同学利用长柄W形玻璃管完成了一氧化碳与氧化铁的反应。已知:甲酸在热浓硫酸的作用下分解生成一氧化碳和水。下列有关实验的说法中错误的是 ( )
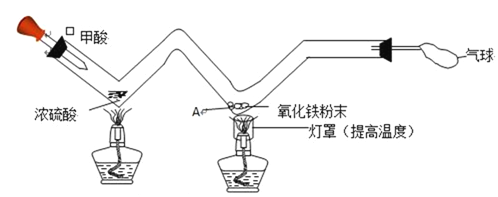
A. 灯罩的作用是,集中火焰,提高酒精灯火焰的温度。
B. A处可观察到的实验现象是:红色粉末变成黑色。
C. A处发生的反应中,一氧化碳夺取氧化铁中的氧,发生还原反应。
D. 该微型实验具有药品用量少、清洁环保、操作简单等优点。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图为甲乙两物质的溶解度曲线,下列说法正确的是( )
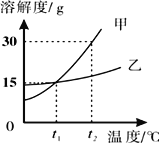
A. 甲的溶解度大于乙的溶解度
B. 要使接近饱和的甲溶液转化为饱和溶液,可采用降温的方法
C. t1℃时,甲、乙两物质饱和溶液中溶质的质量分数均为15%
D. t2℃时,将50g甲物质放入100g水中,得到溶液的质量为150g
查看答案和解析>>
科目: 来源: 题型:
【题目】如图的加热袋常用于野外加热食物。加热袋中的固体粉末含镁粉、铁粉和氯化钠,使用时向其中加入水袋中的水,即可产生大量热。实验小组针对放热过程中的反应原理展开探究。


【查阅资料】
常温下镁粉能与水发生置换反应,且放热。
【进行实验】
同学们用下图所示装置进行模拟实验:分别取不同成分的固体粉末放入甲中,通过分液漏斗向其中均加入8 mL水,读取甲中所得固液混合物的最高温度,实验记录如下表:
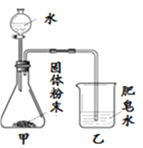
(实验时的室温为22.8℃)
实验序号 | A | B | C | D | E | F |
固体成分 | Mg | Fe | Mg+Fe | Mg+NaCl | Fe+NaCl | Mg+Fe+NaCl |
乙中现象 | 少量肥皂泡,难以点燃 | ______ | 少量肥皂泡,难以点燃 | 较多肥皂泡,点燃有爆鸣声 | 无肥皂泡 | 大量肥皂泡,点燃有爆鸣声 |
混合物温度 | 23.1℃ | 22.8℃ | 23.1℃ | 24.2℃ | 22.8℃ | 27.2℃ |
【解释与结论】
(1)实验B,乙中现象为_______________。
(2)实验A证明了镁粉与水能反应,完成该反应的化学方程式Mg+2H2O=____+H2 ![]() 。
。
(3)使镁粉与水迅速反应并放热的最佳方法是向镁粉中加入_____________。
【反思改进】
(4)同学们分析实验数据发现,升高的温度没有达到食品加热袋的效果,其可能的原因是___________。
(5)同学们根据实验结果进一步猜测,实验F中的反应结束后,甲中剩余固体混合物中仍然含有铁粉,检验其铁粉存在的的验方案为:取少量固体混合物________。
(6)从上述实验初步得出“NaCl溶于水没有热量的变化”的结论,依据的两个实验是(填实验序号)______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学小组的同学用下图所示装置进行如下实验,实验前K1、K2、K3均为关闭状态。
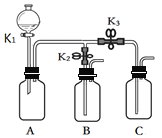
内容 步骤 | 实验步骤 |
实验1 | B、C中分别盛有无色酚酞试液,打开K1,从分液漏斗中加入浓氨水,关闭K1,然后打开K2、K3。 |
实验2 | A中盛满CO2,B中盛有氢氧化钙溶液,C中盛有稀盐酸。 ①打开K1,从分液漏斗慢慢放入适量的氢氧化钠溶液,关闭K1。 ②一段时间后打开K2,观察到有A中有沉淀产生时,迅速关闭K2。 ③再打开K3,观察到A中有气泡产生。 |
(1)实验1中,可以观察到的现象是__________。
(2)实验2中,步骤①中所发生反应的化学方程式为____________________。
(3)实验2中,请解释步骤③产生气泡的原因为____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】请从A或B两题中任选1个作答,若两题均作答,按A计分。
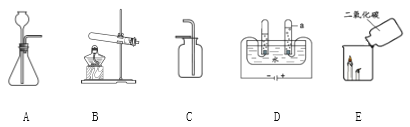
A | B |
(1)实验室用高锰酸钾制取氧气,选取的发生装置是______。 (2)实验室用高锰酸钾制取氧气的化学方程式为___________________。 (3)D中试管a中产生的气为____。 | (1)实验室制取二氧化碳,选取的发生装置是______。 (2)实验室制取二氧化碳的化学方程式为________________。 (3)E中观察到的现象是________。 |
查看答案和解析>>
科目: 来源: 题型:
【题目】尿素[CO(NH2)2]是一种常用化肥。下图为利用天然气制尿素的主要流程。
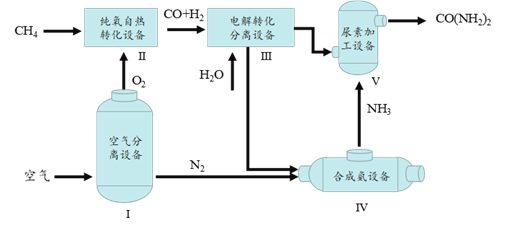
(1)设备Ⅰ内发生的变化是________(填“物理变化”或者“化学变化”)。
(2)设备Ⅱ中发生的反应所属的基本反应类型是_________。
(3)设备Ⅲ中产生并分离出CO2和H2两种物质,依据流程图判断进入设备Ⅳ的是H2,理由是________。
(4)设备Ⅴ中发生反应:2NH3+CO2 ![]() CO(NH2)2+H2O,若生产60 t尿素,需要NH3的质量为_______t。
CO(NH2)2+H2O,若生产60 t尿素,需要NH3的质量为_______t。
查看答案和解析>>
科目: 来源: 题型:
【题目】阅读下面科普短文(本文由网络文章改写)。
松花蛋又称皮蛋、变蛋、灰包蛋等,因剥开蛋壳后胶冻状的蛋清中常有松针状的结晶或花纹而得名,是一种我国传统风味食品,口感鲜滑爽口,色香味均有独到之处。中医认为,松花蛋性凉,对牙痛、眼痛等疾病有一定疗效。由于松花蛋会有一股碱涩味,在吃松花蛋的时候可以加入少量的姜醋汁。
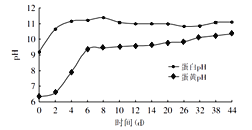
松花蛋是用料泥包裹鸭蛋、鸡蛋等加工而成。料泥是由生石灰、纯碱、食盐、红茶、草木灰(主要成分K2CO3)等原料与水按比例混合均匀制得。料泥制作过程中,通过一系列反应,产生的强碱(NaOH、KOH)经蛋壳渗入到蛋清和蛋黄中,与其中的蛋白质作用,致使蛋白质分解、凝固并放出少量硫化氢气体和氨气。同时渗入的碱还会与蛋白质分解出的氨基酸进一步发生中和反应,生成的盐的晶体沉积在凝胶态的蛋清中,便出现了朵朵“松花”。而硫化氢气体则与蛋清和蛋黄中的矿物质作用生成各种硫化物,使蛋清和蛋黄的颜色发生改变,蛋清呈特殊的茶褐色、蛋黄则呈墨绿色。下图表示松花蛋腌制时间与其中蛋清和蛋黄的pH的变化关系。
很多人在平时生活中都非常喜欢吃皮蛋瘦肉粥、凉拌松花蛋,专家提醒这种食物少吃无妨,却不能过多食用。其一,松花蛋腌制过程中蛋白质分解、变质,导致营养价值遭到了一定的破坏。其二,市售松花蛋还可能含铅(国家规定松花蛋中铅含量需小于0.5mg/kg)。微量铅很容易被儿童吸收,导致铅中毒。其三,剥开皮的松花蛋1至2小时内一定要吃完,若长时间暴露在空气中,非常容易感染沙门氏杆菌,沙门氏杆菌会快速繁殖,此时食用松花蛋很容易引起中毒现象,依据文章内容,回答下列问题。
(1)食用松花蛋时加入少量姜醋汁可以除去松花蛋中________味。
(2)料泥制作过程中会生成强碱NaOH和KOH,钾元素来自于原料中的________。请写出Na2CO3与Ca(OH)2反应的化学方程式为________。
(3)依据松花蛋腌制时间与其中蛋清和蛋黄pH的变化关系判断,当蛋清和蛋黄pH均达到9以上时,松花蛋至少腌制的天数为________(填字母序号,下同)。
A.2天 B.6天 C.12天 D.32天
(4)下列关于松花蛋的说法正确的是________。
A.松花蛋特殊颜色的形成与硫化氢气体有关
B.松花蛋具有很高的营养价值,成人可以多吃
C.市售松花蛋可能含有少量的铅,儿童不宜食用
D.剥开皮的松花蛋隔夜放置后依然可以放心食用
查看答案和解析>>
科目: 来源: 题型:
【题目】A和B点燃条件下反应生成C和D。反应前后分子变化的微观示意图如下:

下列说法不正确的是
A. 一个A分子中含有4个原子 B. D的化学式为H2O
C. 生成物C和D的质量比为14:9 D. 4种物质中,属于化合物的是A和D
查看答案和解析>>
科目: 来源: 题型:
【题目】正常情况下人的胃液pH为0.8—1.5,相应含氯化氢的质量分数为0.2%—0.4%,胃液中氯化氢过多过少都不利于健康。某人出现反胃、吐酸水的症状,经检查其胃液中氯化氢的质量分数为1.495%(胃液密度约为1g/cm3)。
(1)正常情况下,人的胃液显_________性。
(2)若人的胃液总量为100mL,正常胃液中HCl的质量范围为___________________ g。
(3)服用碱性物质可以治疗胃液中HCl含量过多,你认为该患者 ___________ (填能或不能)服用熟石灰来治疗胃酸过多,理由是 ______________________________________ 。
(4)医生给患者开的药是胃舒平[有效成分是Al(OH)3],每片胃舒平含Al(OH)3 的质量为0.39g。请根据化学方程式计算该患者至少服用________片胃舒平,胃液才能恢复正常? (请写出计算过程)
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸氢钠是一种重要的盐类物质,在生活中用途广泛.小滨同学设计了实验,以探究碳酸氢钠的化学性质.
【探究实验1】碳酸氢钠溶液的酸碱性
【实验方案】取少量该固体加入试管中,加适量水溶解,再滴入几滴酚酞溶液,振荡。
现象:溶液变成浅红色.由此得出结论①__________________________;
【探究实验2】能与酸反应
【实验方案】取少量该固体加入试管中,滴加稀盐酸,现象为②_____________________;
【探究实验3】碳酸氢钠的热稳定性
【实验方案】用如下所示装置进行实验
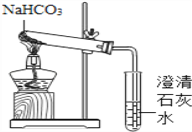
现象:充分加热后,大试管口有水珠出现,管底有白色固体残留,清石灰石变浑浊.
结论:碳酸氢钠受热能生成二氧化碳、水和一种白色固体.
验证:(1)请你帮小滨设计实验,证明试管中留下的白色固体是Na2CO3,而不是NaOH(所选试剂不能用酸).步骤③______________________,现象④_________________________。
(2)写出碳酸氢钠受热分解的化学方程式⑤________________________________________
【拓展应用】试说出碳酸氢钠在日常生活中的一种用途⑥___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com