
科目: 来源: 题型:
【题目】(1)我们已经学习了氢氧化钠的性质,知道这种固体要密封保存,原因有:①___________________;②________________。
兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验:
【对固体猜想】
猜想I:全部是NaOH;猜想II:全部是Na2CO3;猜想III:是NaOH和Na2CO3混合物
【实验和推断】
(2)为进一步确定成分,进行了以下探究:
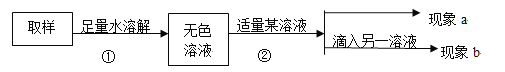
填写以下实验报告:
实验操作 | 实验现象 | 实验结论 |
第一步:用试管取约2mL该无色溶液,滴入适量澄清石灰水。 | 现象a:溶液变浑浊。 | 化学方程式:①___________, 证明有碳酸钠。 |
第二步:静置,取上层清液于另一试管中,滴入无色酚酞溶液。 | 现象b:②__________ | 证明含有NaOH,猜想III成立,是NaOH和Na2CO3混合物 |
③分析:小组中有同学提出质疑,认为以上实验不能证明猜想III成立,理由是:
a、Na2CO3溶液呈碱性; b、__________________________________________________。
(3)兴趣小组按下图实验测定部分变质的NaOH固体中Na2CO3的质量分数。
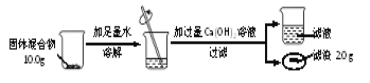
①根据题中信息______(填“能”或“不能”)计算Ca(OH)2溶液的质量分数。
②通过计算,固体混合物中Na2CO3的质量分数是__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验设计是化学实验的重要环节。请根据下列实验要求回答相关问题:
(1)【活动与探究一】用对比实验方法探究二氧化碳的性质。
实验一 | 实验二 |
|
|
①实验一中振荡3个矿泉水塑料瓶,观察到塑料瓶变瘪的程度由大到小顺序为___________,B瓶内变浑浊的化学方程式为________________________。
②实验二观察到C装置中发生的现象是____________、 ________ , 结论是________________ (用化学方程式表示)。
(2)【活动与探究二】定量测定空气中氧气的含量。
实验三 | |
|
|
①实验三中,反应的原理为__________________ (用化学方程式表示);
②装置一比装置二更合理,理由是__________。
根据下表提供的实验数据,完成下表:
硬质玻璃管中空气体积 | 反应前注射器中空气体积 | 反应后注射器中气体体积 | 实验测得空气中氧气体积分数 |
30mL | 20mL | 10mL | ③_________ |
④定量实验操作中易产生误差,如果反应前气球中存在气体(其量小于注射器内的空气),而实验后冷却至室温,将气球内的气体全部挤出读数,导致实验测得结果________ (填“偏小”、“偏大”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是实验室中常用的几种装置,回答下列问题:
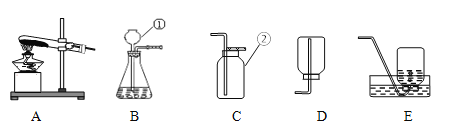
(1)写出有编号仪器的名称:①_____________,②_____________。
(2)利用上述B、C装置的组合可以制取一种可供呼吸的气体是_______,加入药品前应首先________________,制取该气体的化学方程式___________。为防止生成的气体从长颈漏斗逸出,添加的液体应________。
(3)实验室用锌粒与稀硫酸反应制取并收集干燥的氢气,应选用的气体收集装置是____ (填装置代号),该反应化学方程式为_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列是初中化学常见的实验或操作,回答下列问题:
A. 量筒读数 B.
量筒读数 B. 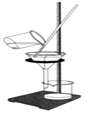 过滤
过滤
C.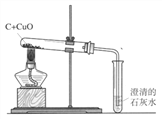 木炭还原氧化铜
木炭还原氧化铜
D.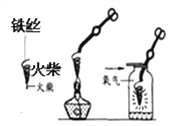 铁丝在氧气中燃烧
铁丝在氧气中燃烧
(1)A实验中读出液体的体积是________mL。
(2)B实验中玻璃棒的作用是__________________。
(3)C实验中看到的实验现象:____________。
(4)D实验把细铁丝盘成螺旋状目的是___________________,集气瓶中放点水的目的是__________ ,铁丝燃烧的化学方程式是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。据图回答:
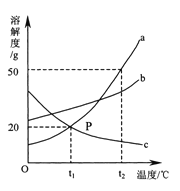
(1)P点的含义是 。
(2)t2℃时30ga物质加入到50g水中不断搅拌,形成的溶液质量是 g。
(3)t2℃时a、b、c三种物质的溶解度按由小到大的顺序排列是 _________(填写物质序号)。
(4)在t2℃时,将等质量的a、b、c三种物质的饱和溶液同时降温至t1℃时,析出晶体最多的是 ,所得溶液中溶质质量分数最小的是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】从微观视角认识和考察物质世界是学习化学的重要思维方法。
(1)下图是某反应的微观示意图:
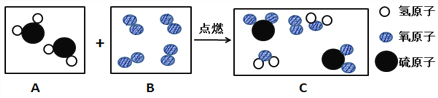
B框中的物质属于________(填序号:①化合物 ②单质 ③纯净物 ④混合物)。此反应化学方程式为____________________。
(2)写出下图A所示的反应化学方程式 _________________ ,属于_____________反应(填反应类型)。该反应前后,溶液减少的离子是 __________。下图B中反应溶液变为无色时,此时溶液中大量存在的粒子是_________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】人类的生活和生产都离不开金属材料。
(1)下列物质不属于合金的是__________。(填序号)
A.青铜 B.铝 C.钢 D.生铁
(2)每年因腐蚀而报废掉的金属材料数量惊人,铁生锈条件是铁与___________同时接触。
(3)工业炼铁可以把赤铁矿(主要成分为Fe2O3 )在高炉里和CO反应,该反应的化学方程式是_________________;
① 氧化铁(Fe2O3)的相对分子质量是_________;
② 2000t含氧化铁80%的赤铁矿中理论上可炼得含铁95%生铁_________t。(保留一位小数)
查看答案和解析>>
科目: 来源: 题型:
【题目】黑木耳是一种营养丰富的食用菌,含有人体必需的钙、铁、胡萝卜素、维生素等营养物质,经常食用可补充人体对铁等微量元素的需求。其中营养成分的具体含量如资料卡片所示。请根据资料回答下列问题:

(1)黑木耳中所含的铁是指___(填字母序号).
A. 分子B.原子C.元素
(2)硫酸亚铁(FeSO4)是常见补铁类保健品中的有效成分之一,请根据其化学式计算:
①硫酸亚铁的相对分子质量为___,
②硫酸亚铁中铁、硫、氧三种元素的质量比为___;
③与200g干黑木耳中的铁元素质量相等的硫酸亚铁的质量为___mg.
查看答案和解析>>
科目: 来源: 题型:
【题目】通过对化学学习,相信你已经初步掌握了实验室制取气体的有关知识.请结合图示回答: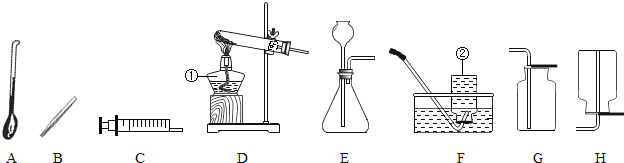
(1)写出图中标示的仪器名称:①___;②___
(2)甲KMnO4制取O2,应选用的发生装置为___(填字母序号,下同),收集装置可选用___(写一种即可);取用KMnO4为___色;写出该反应的化学方程式___.
(3)若用G装置收集氧气,检验氧气是否集满的方法是_____________________
(4)若乙同学用双氧水和二氧化锰来制取氧气,实验前为了控制反应速率,可选用___代替发生装置中某一仪器达到了实验目的实验结束后,乙同学想回收二氧化锰,可用___ (填实验操作名称)的方法分离出二氧化锰。该操作过程中需要用到的玻璃仪器主要有玻璃棒、烧杯和___,其中玻璃棒的作用是___.
(5)若收集气体丙时只能用装置G,则可推知气体丙的性质可能有___.
(6)化学反应速率是衡量化学反应进行快慢的物理量,为了探究影响化学反应速率的因素,以过氧化氢分解为研究对象进行实验。
三个小组均可采用如图装置进行实验,记录收集10mL氧气的时间,实验室可供选择的试剂有:2.5%、5%、10%三种浓度的H2O2溶液、MnO2、CuO、红砖粉末。
A组:探究催化剂对化学反应速率的影响
取5mL10%H2O2溶液,三次实验分别加入0.5gMnO2、红砖粉末、CuO进行实验,记录数据如下:
试剂 | MnO2 | 红砖粉末 | CuO |
t/s | 10 | 60 | 20 |
由此可出结论:MnO2、CuO对H2O2分解有催化作用,红砖粉末无催化作用,某同学对该结论提出疑问。
补充对比实验,操作为___.
结果:长时间(大于100s),收集到很少量气体。
更正结论:红砖粉末___(选填“有”、“无”)催化作用,三者中___催化效率最高。
B组:探究浓度对化学反应速率的影响
甲同学:取10mL5%H2O2溶液,加入0.5gMnO2为催化剂,进行实验,记录时间t1.
乙同学:取10mL2.5%H2O2溶液,加入0.5gMnO2为催化剂,进行实验,记录时间t2.
实验结果___.
结论:浓度越大,反应速率越快。
丙同学:对实验设计提出疑问,并补充实验___.
记录时间t3,且t1
更正结论为:当___时,反应物浓度越大,反应速率越快。
查看答案和解析>>
科目: 来源: 题型:
【题目】小宇和同学们在学习化学之后再次走进科技馆,如图所示的连环画记录了他们的参观过程。请据图和叙述回答I-IV题。
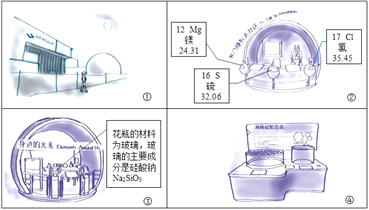
I.今天天气晴朗,空气质量优良。
(1)下列属于空气污染物的是_______(填字母序号).
A.N2B.CO2C.PM2.5D.CO
(2)保护人类赖以生存的空气,是每个公民的责任。小宇能做些什么呢?请你给她的出行提出一条建议:_______
II.来到“与门捷列夫对话”展台。看到熟悉的元素周期表,依据图②中显示的信息回答。
(1)氯的相对原子质量为_______
(2)镁元素是核电荷数为_______的一类原子的总称。镁原子原子的结构示意图为:![]() ,在化学反应中易___(填“得”或“失”)电子。
,在化学反应中易___(填“得”或“失”)电子。
(3)写出图②中一种元素的单质与氧气反应的化学方程式_______.
III.“太空探索”展台周围吸引了很多观众。
航天员出舱所穿的宇航服能为其提供氧气,吸收二氧化碳。用于吸收二氧化碳的物质是氢氧化锂,已知其中锂(Li)的化合价为+1,其化学式为_______
IV.工业上用氨气(NH3)制取硝酸(HNO3),工业流程为:
![]()
①NH3+O2→NO+H2O
②NO+O2→NO2
③NO2+H2O→HNO3+NO
(1)上述反应涉及的物质中,属于氧化物的有_______种.
(2)反应②的基本反应类型为_______.
(3)制取硝酸过程中可循环使用的物质是_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com