
科目: 来源: 题型:
【题目】往硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为m的锌粉,溶液中析出固体的质量与参加反应的锌粉质量关系如图所示,下列说法中正确的是
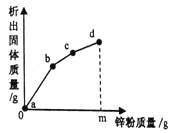
A.c点对应溶液中含有的金属离子为Zn2+和Cu2+
B.bc段(不含两端点)析出的金属是Fe
C.ab段(不含两端点)对应溶液中含有的金属离子为Zn2+、Ag+、Cu2+、Fe2+
D.若bc段和cd段中析出固体质量相等,参加反应的锌粉质量分别为m1和m2,m1>m2
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是甲、乙、丙三种固体物质的溶解度曲线。下列说法错误的是
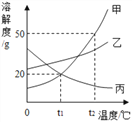
A. t1℃时,甲、丙两种物质的饱和溶液溶质质量分数相同
B. 要从甲物质的饱和溶液中获得晶体甲,可以采用降温的方法
C. t2℃时,30g甲加入到50g水中充分溶解,所得溶液中溶质质量分数为37.5%
D. 将三种物质的饱和溶液从t2℃降温至t1℃,所得溶液中溶质质量分数乙>甲>丙
查看答案和解析>>
科目: 来源: 题型:
【题目】黄铁矿(主要成分为FeS2,杂质高温下不反应。)是我国硫酸厂制取硫酸的主要原料。
某兴趣小组欲测定某黄铁矿中FeS2含量,设计了如下实验 (假设每步反应均完全)。
【查阅资料】 ①4FeS2+11O2 ![]() 2Fe2O3+8SO2 ②Na2SO3+H2O2 =Na2SO4+H2 ③BaSO4为一种不溶于水、不溶于盐酸的沉淀。
2Fe2O3+8SO2 ②Na2SO3+H2O2 =Na2SO4+H2 ③BaSO4为一种不溶于水、不溶于盐酸的沉淀。
【实验探究】
Ⅰ.称取4.80 g黄铁矿样品放入下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。
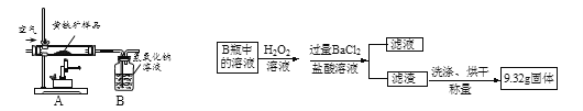
Ⅱ.反应结束后,将B瓶中的溶液按上图流程进行处理。
【问题讨论】
(1)Ⅰ中B瓶内发生反应的化学反应方程式是______和______;
(2)Ⅰ中通入的空气中作用是______和______;
(3)Ⅱ中加入盐酸溶液的目的是______;
(4)Ⅱ中检验滤渣洗涤是否干净的方法是______。
【含量测定】
(5)另取4.80g黄铁矿样品在空气中加热,测出样品的固体残留率(![]() ×100%)随温度的变化如下图所示,计算该黄铁矿中FeS2的质量分数为______。(请写出计算过程)
×100%)随温度的变化如下图所示,计算该黄铁矿中FeS2的质量分数为______。(请写出计算过程)

查看答案和解析>>
科目: 来源: 题型:
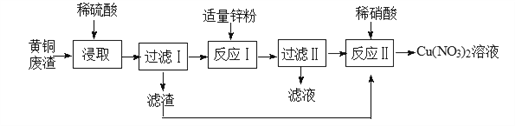
【题目】黄铜灰渣(含有Cu、Zn、CuO、ZnO及少量的FeO、Fe2O3)生产硝酸铜溶液的流程如下:
【资料】:Ⅰ.硝酸受热易分解,且硝酸具有挥发性;
Ⅱ.Cu(NO3)2溶液在温度较高时,易变质;
Ⅲ.Cu(NO3)2·3H2O晶体加热到170℃分解。
(1)实验室过滤时所用的玻璃仪器有玻璃棒、烧杯和_______,玻璃棒的作用为_______;
(2)浸取时将黄铜废渣粉碎的目的是________,写出浸取时FeO和稀硫酸反应的化学方程式为________;
(3)过滤I所得滤渣的成分是___(填化学式);
(4)反应II的发生的化学反应为:3 Cu+8HNO3=3Cu(NO3)2+2X+4H2O,则X为______。反应II应控制温度不能过高也不能过低的原因是________;
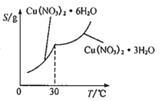
(5)已知Cu(NO3)2·6H2O和Cu(NO3)2·3H2O的溶解度随温度的变化如右图所示。则由Cu(NO3)2溶液获取Cu(NO3)2·3H2O晶体的方法是:蒸发浓缩、____、____、洗涤、低温干燥。若得到的晶体中含有Cu(NO3)2·6H2O,则产品中铜元素的质量分数_____(填“偏大”“不变”或“偏小”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】钠是一种活泼金属,其原子的结构示意图为![]() 。钠在空气中极易被氧化,用小刀一切,就能观察到它的本来面目:银白色有金属光泽。钠还能与水反应,生成氢氧化钠和氢气。1807年,科学家首次利用电解氢氧化钠的方法制备金属钠,同时得到氧气和水。1921年,科学家通过电解熔融氯化钠的方法制备金属钠同样获得成功。根据以上资料,回答下列问题:
。钠在空气中极易被氧化,用小刀一切,就能观察到它的本来面目:银白色有金属光泽。钠还能与水反应,生成氢氧化钠和氢气。1807年,科学家首次利用电解氢氧化钠的方法制备金属钠,同时得到氧气和水。1921年,科学家通过电解熔融氯化钠的方法制备金属钠同样获得成功。根据以上资料,回答下列问题:
(1)在钠的原子结构中,钠原子的质子数为________,最外层电子数为________;
(2)钠具有的物理性质有________(任写一点);
(3)钠与水反应的化学方程式为________;
(4)电解氢氧化钠和电解熔融氯化钠都属于基本反应类型中的________反应;
(5)实验室中的金属钠通常保存在煤油中的原因是________。(填写字母)
A.钠不与煤油反应 B.钠能与氧气反应
C.钠能与水反应 D.钠的密度比煤油的密度大
查看答案和解析>>
科目: 来源: 题型:
【题目】实验小组用下图装置进行实验。
已知:甲瓶中充满二氧化碳,乙中液体是水,实验前K关闭。
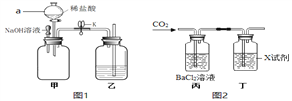
(1)图1装置甲中仪器a的名称____________;
(2)将装置甲中胶头滴管中的浓NaOH溶液挤入瓶中,振荡;打开装置甲中K,观察到乙中的现象是_____,原因是________;接着将装置甲仪器a中的稀盐酸注入甲中,观察到甲中有气泡产生,该反应的化学方程式为________。观察到乙中的现象是____________;
(3)为了充分证明二氧化碳与氢氧化钠能发生反应,某同学设计了图2所示的实验方案,则装置丁中X试剂含有的溶质为______和______(填化学式),装置丙的作用是______;
(4)实验过程中需配制100 g30%的NaOH溶液,需要水的质量是________ g。配制时需要用到的仪器 ____________。(填写字母)
A.托盘天平 B.胶头滴管 C.漏斗 D.量筒
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某学校中午的营养餐如下表所示:

①牛肉中富含的营养素主要是______;
②炒菜时使用铁强化酱油。人体中缺少铁元素,会导致________;
A.佝偻病 B.贫血 C.发育不良
③工业上利用赤铁矿炼铁的化学原理是________。(用化学方程式表示)
(2)国家能源局指出:到2020年,将在全国范围内推广使用车用乙醇汽油。利用农作物秸秆可生产乙醇(C2H6O),主要流程如下图所示:
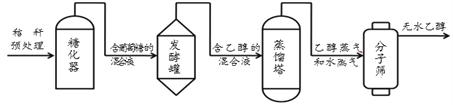
①乙醇中含有____________种元素;
②发酵罐中,葡萄糖(C6H12O6)在酒化酶的催化作用下发生分解反应,生成乙醇和二氧化碳。其化学方程式为________;
③蒸馏塔中发生的是____________(填“物理”或“化学”)变化;
④分子筛的作用是吸附小于筛孔直径的_______(填“水分子”或 “乙醇分子”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化铵、硫酸钾是常见的化肥,请回答下列问题:
(1)氯化铵的化学式______;
(2)铵根离子______(填写离子符号),其氮元素化合价为______;
(3)铵态氮肥不能与碱性肥料混合施用。氯化铵与氢氧化钠溶液共热反应的化学方程式为____。碳酸氢铵应避免在气温较高时使用,其受热分解的化学方程式为________。碳酸氢铵还能与盐酸反应,其化学方程式为________;
(4)下列物质属于复合肥的是____________;(填写字母)
A.氯化铵 B.硝酸钾 C.磷酸二氢铵 D.硫酸钾
(5)氮肥中的“氮”指的是____________。(填写字母)
A.单质 B.元素 C.原子 D.分子
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验室提出了一种煤制氢技术。其流程如下图所示。
资料:Ⅰ.水煤浆是由煤(主要含碳)与水混合而成,经过气化器后转化为CO2和H2。
Ⅱ.在气化器中发生了两个反应:
①C + H2O![]() CO + H2 ② CO + H2O
CO + H2 ② CO + H2O ![]() CO2 + H2
CO2 + H2
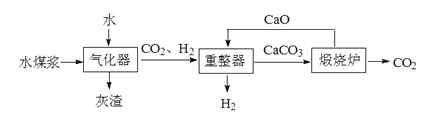
下列说法正确的是
A. 气化器中发生的反应均为置换反应 B. 流程中需不断加入CaO
C. 重整器的作用是分离CO2和H2 D. 100kg氢气燃烧理论上可生成水900kg
查看答案和解析>>
科目: 来源: 题型:
【题目】按下图装置进行实验,倾斜锥形瓶使足量稀盐酸全部倒入,并与固体接触发生反应,瓶内气压的变化如坐标图所示。下列说法错误的是

A. 块状碳酸钙反应速率较快
B. a点所对应的体系中含有CaCl2和HCl
C. 1 g碳酸钙完全反应后,可获得0.44g 二氧化碳
D. 对比分析坐标图中的a、c点或b、d点,可知化学反应速率与反应物的接触面积有关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com