
科目: 来源: 题型:
【题目】在一支试管中放入一小段镁条(已擦去氧化膜),再向试管中加入一定量的盐酸,镁条表面有________产生,反应的化学方程式是________________________________________________________。
[发现问题]为了再次观察上述反应现象,小林同学用较长的镁条重做上述实验,但发现了异常现象,试管中出现了白色沉淀。
[实验验证1]小林同学针对两次实验的不同,设计对比实验方案,探究出现异常现象的原因。
试管(盛有同体积同浓度的盐酸) | ① | ② | ③ | ④ |
镁条长度 | 1cm | 2cm | 3cm | 4cm |
相同的实验现象(省略题干现象) | 快速反应,试管发热,镁条全部消失 | |||
沉淀量差异(恢复至20℃) | 无 | 少量 | 较多 | 很多 |
[得出结论]镁条与盐酸反应产生白色沉淀与________有关。
[追问]白色沉淀是什么物质?
[查阅资料]①20 ℃时,100 g水中最多能溶解氯化镁54.8 g;
②镁能与热水反应产生一种碱和氢气;
③氯化银既不溶于水也不溶于稀硝酸。
[做出猜想]猜想一:镁;猜想二:氯化镁;猜想三:氢氧化镁,猜想的依据是____________________(用化学方程式表示)。
[实验验证2]将白色沉淀洗涤干净,分别取少量沉淀于A、B、C试管中,进行如表实验:
试管 | 操作 | 现象 | 结论 |
A | 加入足量盐酸 | ________,白色沉淀________ | 猜想一不正确,但这种白色沉淀能溶于盐酸 |
B | 加入足量水 | 白色沉淀________ | 猜想二不正确 |
C | 加入适量稀硝酸 | 白色沉淀消失 | 原白色沉淀中含有的离子是: |
继续滴加几滴硝酸银溶液 | 出现大量白色沉淀 |
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是某化学兴趣小组。设计的金属活动性顺序的探究实验。
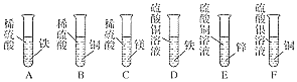
(1)上述实验中,有气泡生成的是________(填写装置序号)。
(2)试管F中出现的实验现象是______________。
(3)上述实验能否证明镁、锌、铁、铜、银五种金属的活动性强弱?____请说明理由_____。
(4)我国古代“湿法炼铜”就是利用了试管D中的反应原理,请写出该反应的化学方程式:______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组的同学从实验室收集到一桶含有硫酸亚铁、硫酸铜的废液,他们想从中回收金属铜和硫酸亚铁晶体,设计了如下实验方案,请结合实验方案回答下列问题:

(1)步骤①中,金属X是________,该反应的化学方程式为_____________________________。
(2)步骤②中,加入过量稀硫酸的目的是___________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属钛因为神奇的性能越来越引起人们关注,常温下钛不与非金属及强酸反应。加热时却可以和常见的非金属单质反应,地壳中的含钛矿石之一是金红石(TiO2),目前大规模生产钛的方法是:
(1)使金红石与炭粉混合,在高温条件下反应,再通入氯气,制得TiCl4和一种可燃气体,该反应的化学方程式为________________。
(2)在氩的气流中,高温下用过量的镁跟TiCl4反应制得金属钛,写出此反应的化学方程式:_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某品牌纯碱中含有杂质NaCl,化学兴趣小组的同学进行了如下实验探究:称取12g样品放入烧杯中,加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如图
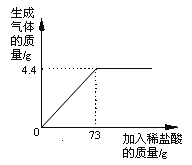
(1)纯碱恰好完全反应时,生成CO2的质量为 g
(2)计算该样品中含杂质的质量分数是多少?(计算结果保留一位小数,下同)
(3)计算当盐酸与纯碱恰好完全反应时,所得溶液的溶质质量分数是多少?
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组的同学在探究Mg、Cu、Fe三种金属的有关性质时进行了如下实验:
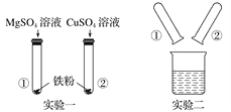
(1)实验一:发生反应的化学方程式________________________________________________,该实验可得出三种金属的活动性由强到弱的顺序为______________________。
(2)实验二:将实验一后①、②试管内的物质倒入烧杯中,发现烧杯内的红色固体明显增多,一段时间后过滤。滤渣中一定含有的物质是________________,可能含有的物质是________________,为了进一步确定可能有的物质是否存在,同学们设计了如下方案:
实验步骤 | 实验现象 | 结论 |
取少量滤渣于试管中,向其中滴加_______________ | 没有气泡产生 | ________ |
滤液中含有的金属离子可能是____________。
①Mg2+ ②Mg2+、Fe2+ ③Mg2+、Fe3+ ④Cu2+、Fe2+ ⑤Mg2+、Fe2+、Cu2+
查看答案和解析>>
科目: 来源: 题型:
【题目】同学们在学习酸碱的化学性质时构建了如图知识网络,A、B、C、D是不同类别的无机化合物,“-”表示物质在一定条件下可以发生化学反应。请回答下列问题:
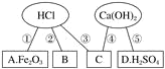
(1)反应①的化学方程式为____________________________________________________;反应的实验现象有___________________________________________。
(2)物质C应是酸、碱、盐中的哪类物质?________。
(3)写出图中一个中和反应的化学方程式________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙两种固体物质的溶解度曲线如图所示,下列结论正确的是( )
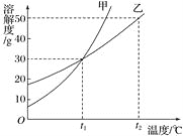
A. 乙的溶解度小于甲的溶解度
B. 甲的溶解度受温度影响比乙大
C. t2℃时,100 g乙的饱和溶液中含乙50 g
D. 相同质量的甲、乙的饱和溶液由t2℃降至t1℃,析出晶体较多的是乙
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用菱锰矿[主要成分为MnCO3,含FeCO3、Cu2(OH)2CO3、SiO2等杂质]为原料来制取二氧化锰,其生产流程示意图如下:
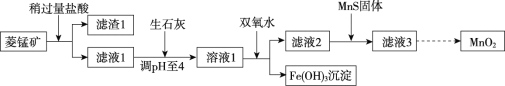
回答下列问题:
(1)将滤液与滤渣分离的操作是______。
(2)向菱锰矿中加入盐酸,MnCO3、FeCO3、Cu2(OH)2CO3都溶解并转化为MnCl2、FeCl2、CuCl2。盐酸与MnCO3反应的化学方程式为________。
(3)加入生石灰将溶液pH调至4,此时溶液呈________(填“酸性”或“碱性”)。
(4)加入双氧水将铁元素转化为Fe(OH)3沉淀,其反应为: 2FeCl2 + H2O2 + 4H2O = 2Fe(OH)3↓ + 4HCl,该反应化合价发生变化的元素是氧和_______。
(5)加入Na2S、MnS等硫化物,均可将MnCl2中混有的CuCl2转化为CuS沉淀除去,但实际生产中选用MnS,其原因是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用下图所示实验装置(气密性良好),验证浓硫酸、浓盐酸的挥发性。其中甲、乙、丙三个广口瓶中依次装有浓硫酸、浓氨水、浓盐酸。
已知:2NH3 + H2SO4 = (NH4)2SO4;(NH4)2SO4为白色固体。
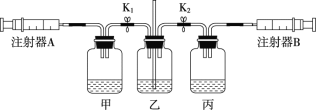
实验步骤 | 实验操作 | 实验现象 |
① | 打开K1,关闭K2,缓慢拉注射器A活塞 | 甲中液面上方无明显现象 |
② | 打开K2,关闭K1,缓慢拉注射器B活塞 | 丙中液面上方出现大量白烟 |
(1)丙中发生化合反应,生成大量白烟(NH4Cl)的化学方程式为________。
(2)该实验能够得出的结论是________。
(3)从微观角度解释甲中无白烟,而丙中出现白烟的原因是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com