
科目: 来源: 题型:
【题目】某研究性学习小组以“酸与碱能否发生反应”为课题进行了实验探究。
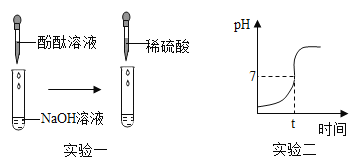
(实验一)
(1)向滴有酚酞试液的NaOH溶液中滴入稀硫酸,观察到溶液颜色由_____,证明硫酸和氢氧化钠发生了反应,该反应的化学方程式为_____。
(2)继续往上述反应后的溶液中逐滴滴入NaOH溶液,不断振荡,如果观察到_____现象,证明了滴加的稀硫酸过量。
(实验二)测量酸和碱反应过程的pH
(1)实验过程中用传感器实时获得溶液的pH,要得到如图所得变化曲线,所进行的操作是_____(填字母)。
A 将稀硫酸溶液逐滴滴加到氢氧化钠溶液中
B 将氢氧化钠溶液逐滴滴加到稀硫酸溶液中
(2)根据如图2溶液pH变化,判断酸和碱发生反应的依据是_____。
(实验三)小组同学经过讨论,一致认为除了上述方法外,还可以按照如表实验方法证明硫酸和氢氧化钠发生了反应。
实验步骤 | 实验现象 | 实验结论 |
取少量氢氧化钠溶液于试管中,加入过量的稀硫酸,再加入少量的氧化铜 | 得到蓝色溶液,无_____ | 氢氧化钠和硫酸发生了化 学反应 |
(拓展延伸)同学们对氢氧化钠溶液和稀硫酸反应后溶液中的溶质成分产生了浓厚的兴趣,于是进行了进一步的探究。
(提出问题)氢氧化钠溶液和稀硫酸反应后溶液中的溶质成分
(提出猜想)猜想一:Na2SO4猜想二:Na2SO4和H2SO4你的合理猜想是:_____。
(进行实验)
实验步骤 | 实验现象 | 实验结论 |
取少量反应后的溶液置于试管中_____ | _____ | 猜想二正确 |
(实验反思)在分析化学反应后所得物质成分时,除考虑生成物外还需要考虑反应物是否有剩余。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化铁常用于金属蚀刻、污水处理等。现以硫铁矿(主要成分是FeS2)为原料制备氯化铁晶体(FeCl36H2O)的流程如图所示:
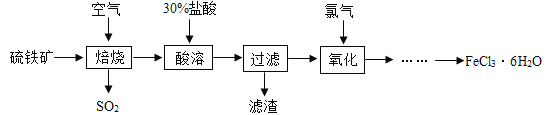
(1)已知“焙烧”阶段就是硫铁矿的燃烧,该反应的化学方程式为4FeS2+11O2![]() 2Fe2O3+8X,则X的化学式为_____,硫铁矿进行焙烧前要将其粉碎,其目的是_____。
2Fe2O3+8X,则X的化学式为_____,硫铁矿进行焙烧前要将其粉碎,其目的是_____。
(2)在“酸溶”时不用硫酸代替盐酸的原因是_____。
(3)实验室常用氢氧化钠溶液来吸收SO2(SO2+2NaOH=Na2SO3+H2O),则吸收6.4g二氧化硫至少需要10%的氢氧化钠溶液的质量是多少?_____
查看答案和解析>>
科目: 来源: 题型:
【题目】A~H是初中化学常见物质。A是日常生活中最常见的金属;B溶液呈现蓝色,常用其配制农药波尔多液;B与C反应生成D和E;其中D为蓝色沉淀,F的固态常被称为“干冰”且能与C反应生成G和H,G俗称为纯碱。
(1)A和F的化学式分别为_____、_____。
(2)实验室检验气体F的试剂为_____。
(3)C的俗名为_____(只要写一个),A与B反应的类型是_____反应。
(4)B与C反应的化学方程式为_____,G转化为C的化学方程式_____。
(5)物质D在加热条件下能分解成两种氧化物,请写出D受热分解的化学方程式_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】生活离不开化学
(1)大米、面粉等食物主要营养成分是_____,鱼是人体摄入铁元素的食物来源之一,人体缺铁会引起_____。
(2)用灯帽盖灭酒精灯火焰的原理是_____。
(3)家用净水器利用活性炭的_____性,除去有色、有味的杂质。生活中硬水转化为软水常用的方法是_____。
(4)氢气是清洁能源,其燃烧的化学方程式为_____。
(5)铁是应用最广泛的金属。
①喷漆能防止铁生锈,原因是_____。
②工业炼铁时,一氧化碳和赤铁矿(主要成分是氧化铁)发生的主要反应的化学方程式为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是实验室常用的实验仪器与装置,根据所学知识回答下列问题:
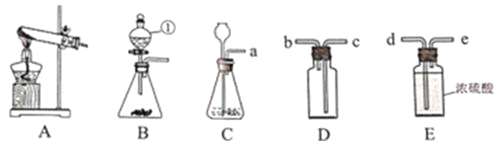
(1)写出图中编号仪器名称:①_____。
(2)用A装置制取氧气时,反应的化学方程式为_____。若用装置B制取氧气则反应的化学方程式为_____,装置B和装置C比较优点是_____。
(3)实验室制取二氧化碳的化学方程式为_____,若要收集一瓶干燥的二氧化碳气体,整套装置导管接口的正确连接顺序是a→_____(依次填导管接口,用a、b、c…表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学设计的工业制备氢氧化钠的流程如图,下列说法正确的是( )
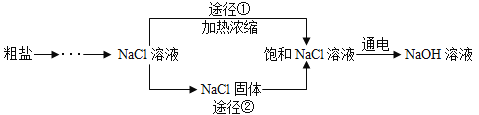
资料:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,两电极一端得到NaOH和H2,另一端得到Cl2。
2NaOH+H2↑+Cl2↑,两电极一端得到NaOH和H2,另一端得到Cl2。
A. 晾晒海水得到粗盐的原理是降温结晶
B. 实验室测定水的组成时,为了增强水的导电性,可以在水中加入氯化钠
C. 工业生产应选择途径①进行生产,因为该途径步骤简单,节约能源
D. 生产过程中得到的Cl2可用于自来水的消毒杀菌
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是KNO3、MgSO4、NaCl三种物质的溶解度曲线。下列说法正确的是( )
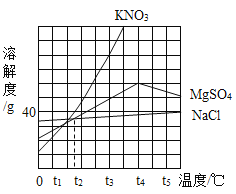
A. t2℃时,把40g KNO3放入50g水中能得到KNO3饱和溶液,其中溶质和溶液的质量比为4:9
B. t3℃时,图中三种物质的饱和溶液降温至t1℃,所得溶液中溶质质量分数大小关系为NaCl>MgSO4>KNO3
C. t4℃时,其他条件不变,把MgSO4饱和溶液升温到t5℃,在此操作过程中溶液里无明显现象
D. KNO3中含有少量的NaCl杂质,采用蒸发结晶法提纯
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组在实验室里进行木炭还原氧化铜的实验。
(实验1)装置如图。
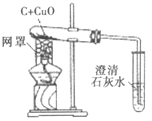
(1)木炭还原氧化铜的化学方程式为__,当碳与氧化铜的质量比为__(写最简整数比)时恰好完全反应。
(2)下列有关本实验的说法正确的是____(填字母)。
A 酒精灯加网罩以使火焰集中并提高温度
B 氧化铜发生了还原反应,木炭发生了氧化反应
C 观察到石灰水变浑浊即可证明氧化铜被还原了
D 反应后先撤出导气管,待试管冷却后再把其中的粉末倒出
(提出问题)实验1中,加热5分钟后仅能得到混有少量红色固体的黑色粉末。如何让木炭还原氧化铜时得到更多的铜呢?
(实验2)该小组同学在老师的指导下改进了实验,装置如图,加热2分钟后即得到紫红色有金属光泽的块状固体,且无黑色固体剩余。
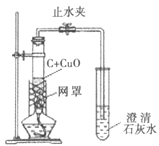
(1)刚烘干的木炭粉末与氧化铜粉末要在同一个研钵内充分研磨、混合均匀后再放入试管,这样做能使反应更充分,其主要原因是__。
(2)本实验所用的木炭与氧化铜的质量比为1︰10,碳需要略过量才能使氧化铜全部被还原,其主要原因是____。
(3)反应物放入试管后要尽量压实,并将试管竖直进行加热,使其下部完全被外焰包围,受热均匀,获得持续的高温。
(4)反应后关闭止水夹,让产物自然冷却,这时试管里残余的________就成了保护气。
(5)加了网罩的酒精灯火焰最高温度能达到800℃,而铜的熔点是1083℃。本实验获得了经熔化而成珠状或小块状的铜,可以推测木炭还原氧化铜的反应是________热量的。
(查阅资料)木炭还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+H2SO4=CuSO4+Cu+H2O。
(拓展探究)将实验2得到的紫红色有金属光泽的块状固体全部研磨成粉末。
(1)将全部粉末放入烧杯中,加入足量稀硫酸,充分反应后,观察到______,证明实验2得到的铜中含有氧化亚铜;再经过滤、洗涤、干燥,得到纯净的单质铜1.52g。
(2)已知实验2使用的氧化铜粉末的质量为2.00g,不考虑实验过程中的损耗,则实验2得到的紫红色有金属光泽的块状固体中,单质铜的质量分数为______(计算结果保留一位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】图中A~I是初中化学常见的物质,且分别由H、C、O、Na、Al、S、Cl、Ca、Cu中的一种或几种元素组成。A为单质,F、G、I由两种元素组成,其余物质由三种元素组成;C俗称纯碱;反应①和②各生成一种沉淀,且沉淀颜色不同;实验室里和工业上制取气体I,均需要主要成分为H的原料。图中“—”表示两端的物质间能发生化学反应,“→”表示物质间存在转化关系,反应条件、部分反应物和生成物已略去。

(1)写出化学式:C________。
(2)写出化学方程式:实验室里制取气体I_________,反应①________,A与B 反应________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物叫做溶液。
(1)在实验室里配制50g质量分数为6%的氯化钠溶液时,需要用到的仪器有托盘天平、_、_、药匙、量筒、胶头滴管、试剂瓶。
(2)某化学兴趣小组利用温度传感器研究几种常见物质溶解时溶液的温度变化,结果如图所示,可知氯化钠溶解时溶液的温度略微降低,氯化铵和___(写物质名称)溶解时溶液的温度降低较多,___(写物质名称)溶解时溶液的温度升高较多。
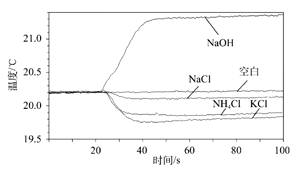
(3)在氯化钠的溶解过程中发生了两种变化:一种是离子向水中扩散,这一过程吸收热量Q1;另一种是离子和水分子作用,形成水合离子,这一过程放出热量Q2。
①氯化钠溶解时溶液的温度略微降低,原因是Q1____Q2(填“>”或“<”)。
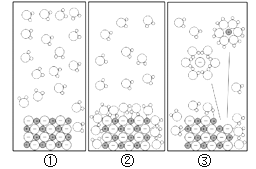
②若氯化钠溶解于水的微观过程如上图所示,则形成的水合钠离子中,钠离子与水分子的个数比为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com