
科目: 来源: 题型:
硫酸铜在化工和农业方面有很广泛的用处,某化学兴趣小组查阅资料,用两种不同的原料制取硫酸铜。
方式一:一种含铜的矿石(硅孔雀石矿粉),含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O(含有SiO2、FeCO3、Fe2O3、Al2O3等杂质)。以这种矿石为原料制取硫酸铜的工艺流程如下图:
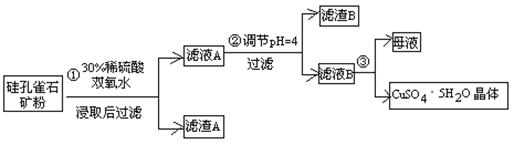
请回答下列问题:
⑴完成步骤①中稀硫酸与CuSiO3·2H2O发生反应的化学方程式
CuSiO3·2H2O+H2SO4=CuSO4 +________+H2O;
⑵步骤②调节溶液pH选用的最佳试剂是__________________
A. CuO B. MgO C. FeCO3 D NH3·H2O
⑶有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
由上表可知:当溶液pH=4时,不能完全除去的离子是________。
⑷滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到CuSO4·5H2O晶体。某同学认为上述操作会伴有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下,Al2(SO4)3饱和溶液中C(Al3+)=2.25mol·L-1,Ksp[Al(OH)3]=3.2×10-34) ________(填“正确”或“错误”)。
方式二:以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
 Ⅱ.采用如下装置进行电化学浸出实验,将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。[]
Ⅱ.采用如下装置进行电化学浸出实验,将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。[]
 Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相)R2Cu
(有机相)+ 2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(5)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S 2Fe3+ + H2S = 2Fe2+ + S↓+ 2H+
电解过程中,阳极区Fe3+的浓度基本保持不变,原因是____________________(用电极反应式表示)。
(6)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是_____________ 。
(7)步骤Ⅳ,若电解0.1mol CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 ____ 。
查看答案和解析>>
科目: 来源: 题型:
Mg(ClO3)2常用作催熟剂、除草剂等,下图为制备少量Mg(ClO3)2·6H2O的方法:
已知:1、卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
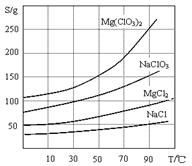
2、几种化合物的溶解度 (S)随温度(T)变化曲线如上图。
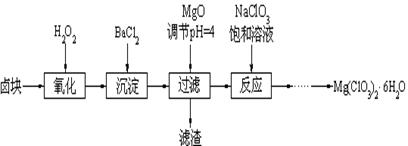 (1)加入BaCl2的目的是除_________,如何判断该离子已除尽_____________________。
(1)加入BaCl2的目的是除_________,如何判断该离子已除尽_____________________。
(2)加入NaClO3饱和溶液会发生反应:MgCl2+2NaClO3==Mg(ClO3)2+2NaCl↓,请利用该反应,结合溶解度图,制取Mg(ClO3)2·6H2O的实验步骤依次为:
①取样,加入NaClO3饱和溶液充分反应;②蒸发浓缩;③ ;④冷却结晶;
⑤过滤、洗涤,获得Mg(ClO3)2·6H2O晶体。
产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50g产品溶解定容成100mL溶液。
步骤2:取10mL配好的溶液于锥形瓶中,加入10mL稀硫酸和20mL1.000mol/L的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol/L K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:
Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL。
(3)写出步骤2中所发生反应的离子方程式 。
(4)步骤3中若滴定前用标准液润洗滴定管,会导致最终结果 (填“偏大”、“偏小”或“不变”)。
(5)产品中Mg(ClO3) 2·6H2O的质量分数为 (计算结果保留两位小数) 。
查看答案和解析>>
科目: 来源: 题型:
碳及其化合物有广泛的用途。
(1)C(s)+ H2O(g) 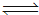 CO(g) +H2(g) ΔH= +131.3 kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2的产率的是 。(填序号)
CO(g) +H2(g) ΔH= +131.3 kJ•mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2的产率的是 。(填序号)
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)又知,C(s)+ CO2(g)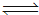 2CO(g) △H=+172.5kJ•mol-1
2CO(g) △H=+172.5kJ•mol-1
则CO(g)+H2O(g)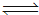 CO2(g)+H2(g)的△H=
CO2(g)+H2(g)的△H=
(3)CO与H2在一定条件下可反应生成甲醇,甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为 。
 (4)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
(4)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
| t / min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
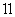 其他条件不变,降低温度,反应达到新平衡前v(逆)______v(正)(填“>”、“<”、“=”)
其他条件不变,降低温度,反应达到新平衡前v(逆)______v(正)(填“>”、“<”、“=”)
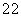 该温度下此反应的平衡常数K=___________
该温度下此反应的平衡常数K=___________
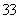 其他条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数___________(填“增大”、“减小”、“不变”)。
其他条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数___________(填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目: 来源: 题型:
向10.4g Fe3O4、Fe2O3、Cu的混合物中加入1 mol·L−1的硫酸溶液140mL时,固体恰好完全溶解,所得溶液中不含Fe3+,若用过量的H2在高温下还原相同质量的原混合物,固体减少的质量为( )
A.1.12g B.2.24g C.3.24g D.6.42g
查看答案和解析>>
科目: 来源: 题型:
下列比较中,正确的是( )
A.同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大
B.物质的量浓度相等的NH4Cl和 NaOH溶液等体积混合后:
c(NH )>c(Cl)>c(Na)>c(OH)>c(H)
)>c(Cl)>c(Na)>c(OH)>c(H)
C.物质的量浓度相等的H2S和NaHS混合溶液中:
c(Na)+ c(H)=c(S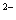 )+ c(HS)+ c(OH)
)+ c(HS)+ c(OH)
D.同物质的量浓度的下列溶液中,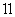 NH4Al(SO4)2、
NH4Al(SO4)2、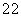 NH4Cl、
NH4Cl、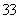 CH3COONH4、
CH3COONH4、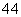 NH3·H2O;c(NH
NH3·H2O;c(NH )由大到小的顺序是:
)由大到小的顺序是: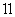 >
>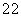 >
>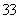 >
>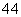
查看答案和解析>>
科目: 来源: 题型:
用酸性氢氧燃料电池为电源进行电解的实验装置如下图所示。下列说法正确的是( )
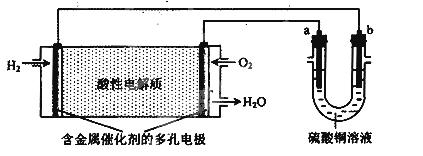
A. a为负极,b为正极
B.若a极是铁,b极是铜,b极逐渐溶解,a极上有铜析出
C.若a、b极都是石墨,在相同条件下,理论上a极产生的气体与电池中消耗的O2体积相等
D.若电解精炼粗铜时,b极是粗铜,a极是纯铜
查看答案和解析>>
科目: 来源: 题型:
实验室需配制一种仅含五种离子(不考虑水解和水电离出的离子)的混合溶液,且在混合溶液中五种离子的物质的量浓度均为5 mol/L,下面四个选项中能达到此目的的是( )
A.Na+、K+、SO42−、NO3−、Cl− B.Fe2+、H+、Br−、NO3−、Cl−
C.Ca2+、K+、OH−、Cl−、NO3− D.Al3+、Na+、Cl−、SO42−、NO3−
查看答案和解析>>
科目: 来源: 题型:
下列实验装置或操作正确的是 ( )
|
|
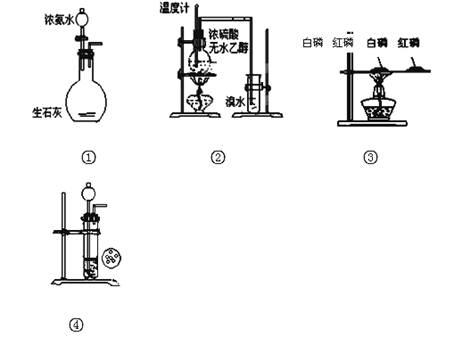
A.实验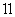 制取氨气
制取氨气
B.实验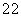 溴水褪色证明了乙烯可以与溴发生加成反应
溴水褪色证明了乙烯可以与溴发生加成反应
C.实验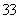 比较红磷和白磷的着火点
比较红磷和白磷的着火点
D.实验 用CaC2和饱和食盐水反应制取C2H2
用CaC2和饱和食盐水反应制取C2H2
查看答案和解析>>
科目: 来源: 题型:
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
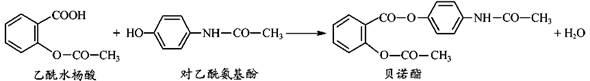
下列有关叙述正确的是 ( )
A.乙酰水杨酸和对乙酰氨基酚均能与NaHCO3 溶液反应
B.可用FeCl3 溶液区别乙酰水杨酸和贝诺酯
C.贝诺酯分子中有2种含氧官能团
D.贝诺酯与足量NaOH 溶液共热,生成乙酰水杨酸钠和对乙酰氨基酚钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com