
科目: 来源: 题型:
利用一种新型陶瓷(能传递H+),实现了氨的电化学合成。该过程N2和H2的转化率远高于现在工业上使用的氨合成法。对于电化学合成氨的有关叙述正确的是( )
A.N2在阴极上被氧化 B.可选用铁作为阳极材料
C.阳极的电极反应式是N2+6H++6e-===2NH3
D.该过程的总反应式是N2+3H2  2NH3
2NH3
查看答案和解析>>
科目: 来源: 题型:
用下列装置能达到预期目的的是( )
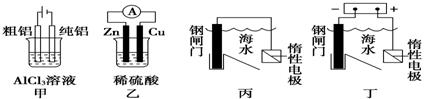
A.甲图装置可用于电解精炼铝 B.乙图装置可得到持续、稳定的电流
C.丙图装置可达到保护钢闸门的目的 D.丁图装置可达到保护钢闸门的目的
查看答案和解析>>
科目: 来源: 题型:
将0.1 mol·L-1的下列物质的水溶液,从常温加热到90 ℃,溶液的pH几乎不变的是(不考虑水的蒸发)( )
A.氯化钠 B.氢氧化钾 C.硫酸 D.硫酸铵
查看答案和解析>>
科目: 来源: 题型:
用惰性电极电解下列物质的溶液,一段时间后,再加入一定质量的另一种物质(括号内),溶液能与原来溶液完全相同的是( )
A.CuCl2[CuO] B.NaOH[Na2O] C.NaCl[HCl] D.CuSO4[Cu(OH)2]
查看答案和解析>>
科目: 来源: 题型:
有关合成氨工业的下列说法中,正确的是( )
A.从合成塔出来的混合气体,NH3的含量较小,所以生产氨的工厂的效率都很低
B.由于氨可液化分离出来,N2、H2在实际生产中循环使用,所以总体来说氨的产率很高
C.合成氨工业的反应温度控制在500 ℃,目的是使化学平衡向正反应方向移动
D.合成氨厂采用的压强是20 MPa~50 MPa,因在该压强下铁触媒的活性最大
查看答案和解析>>
科目: 来源: 题型:
串联电路中四个电解池分别装有0. 5 mol·L-1的下列溶液,用惰性电极电解,连接直流电源一段时间后,溶液pH最小的是( )
A.KNO3溶液 B.NaCl溶液 C.AgNO3溶液 D.CuCl2溶液
查看答案和解析>>
科目: 来源: 题型:
白磷在高压下隔绝空气加热后急速冷却,可得深灰色固体——黑磷,其转化过程中能量变化如图所示。下列叙述中正确的是( )

A.黑磷比白磷稳定 B.黑磷与白磷互为同分异构体
C.白磷转化为黑磷是氧化还原反应 D.白磷转化为黑磷是吸热反应
查看答案和解析>>
科目: 来源: 题型:
下图是某化学兴趣小组设计的利用电子垃圾(含70%Cu、25%Al、4%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线:
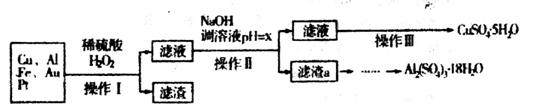
已知下列信息:Cu可与稀硫酸和H2O2的混合液反应生成硫酸铜;铁、铝、铜等离子以氢氧化物形式沉淀时溶液的pH如下表:
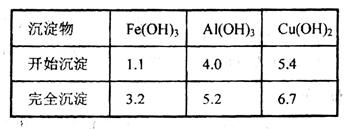
请回答下列问题:
(1)写出Cu与稀硫酸和H2O2的混合液反应的化学方程式______________。
(2)在操作II中,x的取值范围是___________________。
(3)在操作III中,蒸发浓缩需要的玻璃仪器有______________________________________。
(4)由滤渣a制取Al2(SO4)3•18H2O,探究小组设计了三种方案:
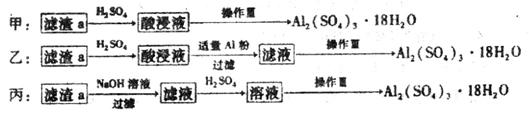
综合考虑上述三种方案,最具可行性的是___________(填序号)。
(5)为测定CuSO4•5H2O晶体的纯度,进行下列实验:取a g 试样配成100mL溶液,每次取20.00mL,消除干扰离子后,用b mol/LEDTA(Na2H2Y)标准溶液滴定其中的Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,平均消耗EDTA溶液12.00mL,CuSO4•5H2O晶体的纯度是_________。
查看答案和解析>>
科目: 来源: 题型:
氨气是一种重要的化工产品及工业原料。
I.某温度下,合成氨反应的平衡常数K=3.0×103(mol/L)-1,
(1)写出其对应的化学方程式____________________________________________________ 。
(2)某温度下,如果在体积恒定为10L的密闭容器中充入:0.1molN2、0.1molH2和2molNH3则反应_______(填“正向进行”或“逆向进行”或“达到平衡”)。
(3)该温度下,在体积恒定为10L的四个密闭容器中分别充入下列物质,反应达到平衡后,N2的转化率最大的是___________________。
a.10molN2、30molH2和20molNH3 b.10molN2和30molH2
c.20molN2和60molH2 d.10molN2和28molH2
II.氨气极易溶于水,氨水是氨气溶于水而形成的溶液,回答下列问题:
(4)在氨水溶液中加水稀释的过程,NH3·H2O的电离程度___________(填“增大”“减小”或“不变”), ___________(同上)。
___________(同上)。
(5)室温下,a mol/L的(NH4)2SO4水溶液的pH=5,原因是溶液中存在平衡________________________(用离子方程式表示)。并计算该平衡的平衡常数表达式为________________________(用含代数a的较为精确的数学表达式表示,不必化简,不做近似运算)。
(6)室温下,向浓度均为0.1mol/L的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为_________________________________________。
(已知:室温时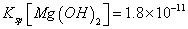 mol3
mol3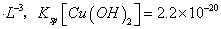 mol3.L-3).
mol3.L-3).
查看答案和解析>>
科目: 来源: 题型:
目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝。
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=_1275.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H=_556.0kJ•mol-1
③H2O(g)=H2O(l)△H=-44.0kJ•mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___________________。
(2)某同学利用甲醇(酸性)燃料电池为电源,设计了一种电解法制取Fe(OH)2的实验装置(如下图)。通电后,下图竖直装置下端B极上有大量气泡产生,溶液中产生大量的Fe(OH)2白色沉淀,且较长时间不变色。则电源中b极为______极(填“正”或“负”),其电极反应式为__________________,装置上端A极电极材料是: ____(填化学式),B电极上的电极反应式为____________。
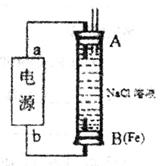
(3)利用电解法在铁制品上镀铜可以防止铁被腐蚀,以下说法正确的是_____。
a.电镀时,通常用铜做阳极,可溶性铜盐作电解质溶液
b. 电镀过程中,维持电流恒定,温度升高,电解反应速率加快
c.电镀过程中,电能全部转化为化学能
d.电镀过程中,铜离子向阴极移动,发生还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com