
科目: 来源: 题型:
下列关于硅单质及其化合物的说法正确的是
 ①硅是构成一些岩石和矿物的基本元素
①硅是构成一些岩石和矿物的基本元素
 ②水泥、玻璃、水晶饰物都是硅酸盐制品
②水泥、玻璃、水晶饰物都是硅酸盐制品
 ③高纯度的硅单质广泛用于制作光导纤维
③高纯度的硅单质广泛用于制作光导纤维
 ④陶瓷是人类应用很早的硅酸盐材料
④陶瓷是人类应用很早的硅酸盐材料
 A.①② B.②③ C.①④ D.③④
A.①② B.②③ C.①④ D.③④
查看答案和解析>>
科目: 来源: 题型:
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的 pH 在 5.0~6.0 之间,通过电解生成 Fe(OH)3 沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成 浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置如图所示: (1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,则无法使悬浮物形成浮渣。
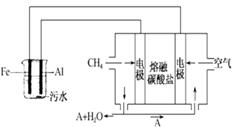

此时,应向污水中加入适量的_________。
a. H2SO4 b.BaSO4 c.Na2SO4 d.NaOH e.CH3CH2OH
(2)电解池阳极的电极反应分别是①______________;
②4OH--4e-=2H2O+O2↑
(3)电极反应①和②的生成物反应得到 Fe(OH)3 沉淀的离子方程式是__________。
(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以 CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应是 CH4+4CO2-8e-===5CO2+2H2O。
①正极的电极反应是______________。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。 则 A 物质的化学式是___________。
(5)实验过程中,若在阴极产生了 44.8L(标准状况)气体,则熔融盐燃料电池消耗 CH4_____L(标准状况)。
查看答案和解析>>
科目: 来源: 题型:
2014 年 3  月 21 日是第二十二届“世界水日”,保护水资源,从我做起!
月 21 日是第二十二届“世界水日”,保护水资源,从我做起!
(1)ClO2和Cl2(还原产物都为Cl-)是生活中常用的消毒剂。当消耗等物质的量的两种物质时,ClO2的消毒效率是Cl2的____________倍。
2)某无色废水中可能含有 Fe3+、Al3+、Mg2+、Na+、NO-、CO32-、SO42-离子中的几种,为分析其成分,分别取废水样品 100 mL,进行了三组实验,其操作和有关现象如下图所示:
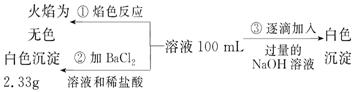
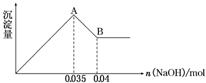
请根据上图回答下列问题:
①实验中需配制 1.0 mol/L的NaOH溶液100 mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管, 还缺少的仪器为_________。
②实验③中沉淀量由 A→B过程中所发生反应的离子方程式为__________。
③试确定NO3-是否存在?_______(填“存在”、“不存在”或“不确定”),若存在,试计算 c(NO3-)=____________(若不存在,此问不必作答)。
查看答案和解析>>
科目: 来源: 题型:
汽车尾气里含有的NO气体是由内燃机燃烧时产生的高温引起氮气和氧气反应所致:N2(g)+O2(g)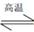 2NO(g)
2NO(g) 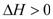
已知该反应在 2404℃时,平衡常数 K=6.4×10-3。请回答下列问题。
2404℃时,平衡常数 K=6.4×10-3。请回答下列问题。
(1)该反应的平衡常数表达式为 。
(2)该温度下,向 2 L 密闭容器中充入 N2 和 O2 各 1 mol,平衡时,N2 的转化率是 %(保留整数)。
(3)该温度下,某时刻测得容器内 N2、O2、NO的浓度分别为2.5×10-1mol·L-1、4.0×10-2mol·L-1和3.0×10-3mol·L-1,此时反应________(填“处于化学平衡状态”、“向正方向进行”或“向逆方向进行”),理由是_______。
(4)将 N2、O2 的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是_________。
(5)向恒温恒容的密闭容器中充入等物质的量的 N2 和 O2,达到平衡状态后再向其中充入一定量 NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数_________(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Zn、Ni且均显+2 价,下同)由铁酸盐(MFe2O4)经高温还原而得。常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
价,下同)由铁酸盐(MFe2O4)经高温还原而得。常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
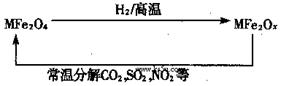
(1)已知铁酸盐(MFe2O4)被H2高温还原时,发生反应的MFe2O4与H2的物质的量之比为 2︰1,则还原产物 MFe2Ox 中x=______,MFe2Ox 中+2价铁与+3价铁的量之比为_____。
(2)在酸性溶液中,Fe2O42-易转化为Fe2+:Fe2O42-+2e-+8H+→2Fe2++4H2O有 KMnO4、Na2CO3、Cu2O、Fe2(SO4)3 四种物质中的一种能使上述还原过程发生,写出该氧化还原反应的离子方程式并配平_________________。
查看答案和解析>>
科目: 来源: 题型:
某温度下在容积为 2L 的密闭容器中,发生反应 2X(g) + Y(g) 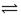 2W(g);△H<0,当充入 2 mol X 和 1 mol Y,经20 s达到平衡时生成了 0.4 molW。下列说法正确的是()
2W(g);△H<0,当充入 2 mol X 和 1 mol Y,经20 s达到平衡时生成了 0.4 molW。下列说法正确的是()
①升高温度,W 的体积分数减小,△H 增大
②以 Y 的浓度变化表示的反应速率为 0.01 mol/(L·s)
③在其它条件不变的情况下,增加 1 mol X ,则 X 和 Y 的转化率均提高
④增大压强,正反应速率增大,逆反应速率减小,则平衡向正反应方向移动
⑤再向容器中通入 2 mol X 和 1 mol Y,达到平衡时,X 、Y 的转化率均增大。
、Y 的转化率均增大。
A、①⑤ B、⑤ C、②③④ D、④⑤
查看答案和解析>>
科目: 来源: 题型:
如图所示,X、Y、Q、W 都是惰性电极,将电源接通后,W 极附近颜色逐渐加深。下列说法中不正确的是( )

A、电源的 M 极为正极
B、甲装置中溶液的 pH 减小
C、甲装置的两个电极上都有单质生成且物质的量之比为1:1
D、欲用乙装置给铜镀银,U 极应该是 Ag,电镀液选择 AgNO3 溶液
查看答案和解析>>
科目: 来源: 题型:
已知硫酸亚铁溶液中加入过氧化钠时发生反应:
4Fe2++4Na2O2+6H2O= 4Fe(OH)3↓+O2↑+8Na+ 则下列说法正确的是( )
A、该反应中 Fe2+是还原剂,O2 是还原产物
B、4molNa2O2 在反应中共得到 8NA 的电子
C、Fe(OH)3 既是氧化产物又是还原产物,每生成 4mol Fe(OH)3 反应过程中共转移电子 6mol
D、反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com