
科目: 来源: 题型:
(8分) 二甲醚(CH3OCH3)简称CME,是一种理想的煤基清洁燃料,可由生物甲烷或天然气合成。合成二甲醚主要步骤为造气和合成。过程如下:
![]()
 |
![]()
![]()
![]()
![]()
(1)生物甲烷是由植物在一定条件下发酵(代谢产物为相等物质的量的CH4和CO2 )而制得,植物纤维素发酵制得甲烷的化学方程式为 。
![]() (2)若162 kg纤维素含量为10%的农作物桔杆,在微生物作用下完全转化为CH4和CO2,通入适量的水蒸气合成二甲醚,理论上最多可得到 kg的二甲醚。
(2)若162 kg纤维素含量为10%的农作物桔杆,在微生物作用下完全转化为CH4和CO2,通入适量的水蒸气合成二甲醚,理论上最多可得到 kg的二甲醚。
![]() (3)若天然气中只含CH4,空气中只含N2和O2,且体积比为4∶1。某企业用标准状况下22.4 m3天然气及水蒸气、空气为原料生产二甲醚,同时利用N2与H2合成氨。在合成二甲醚的同时,理论上还可得到多少千克的NH3?(假设天然气完全反应后的N2全部转化为NH3,且生产过程中转化率均为100%;合成塔中水与CO不反应)
(3)若天然气中只含CH4,空气中只含N2和O2,且体积比为4∶1。某企业用标准状况下22.4 m3天然气及水蒸气、空气为原料生产二甲醚,同时利用N2与H2合成氨。在合成二甲醚的同时,理论上还可得到多少千克的NH3?(假设天然气完全反应后的N2全部转化为NH3,且生产过程中转化率均为100%;合成塔中水与CO不反应)
查看答案和解析>>
科目: 来源: 题型:
(12分)DAP-A树脂是一种优良的热固性树脂,被用作高级UV油墨的一种成分。用UV油墨印刷的优点是:印刷时油墨极快干燥;对环境及人员无损害;性价比较高。因此,适于大规模生产食品、酒类、洗条剂等包装纸盒。这种材料可采用下列合成路线:
 |
![]()
![]()
![]()
![]() 试回答下列问题:
试回答下列问题:
![]() (1)在①~④的反应中属取代反应的是 。
(1)在①~④的反应中属取代反应的是 。
![]() (2)写出反应②的化学方程式 。
(2)写出反应②的化学方程式 。
![]() (3)写出反应⑤的化学方程式 。
(3)写出反应⑤的化学方程式 。
![]() (4)工业上可由C经过两步反应制得甘油,这两步反应的反应类型依次是 和 。
(4)工业上可由C经过两步反应制得甘油,这两步反应的反应类型依次是 和 。
![]() (5)写出B苯环上的二氯代物结构简式: 。
(5)写出B苯环上的二氯代物结构简式: 。
查看答案和解析>>
科目: 来源: 题型:
(8分)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。
![]() (1)某温度下,SO3(g)
(1)某温度下,SO3(g)![]() SO2(g)+1/2O2(g);△H= +98 kJ?mol-1。开始时在100L的密闭容器中加入4.0mol SO2(g)和10.0molO2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=
SO2(g)+1/2O2(g);△H= +98 kJ?mol-1。开始时在100L的密闭容器中加入4.0mol SO2(g)和10.0molO2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K=
![]() (2)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)
(2)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)![]() 2SO3(g)达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是 。
2SO3(g)达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是 。
![]() A.保持温度和容器体积不变,充入2mol SO3
A.保持温度和容器体积不变,充入2mol SO3
![]() B.保持温度和容器体积不变,充入2mol N2
B.保持温度和容器体积不变,充入2mol N2
![]() C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
![]() D.保持温度和容器内压强不变,充入1mol SO3
D.保持温度和容器内压强不变,充入1mol SO3
![]() E.升高温度
E.升高温度
![]() F.移动活塞压缩气体
F.移动活塞压缩气体
![]() (3)某人设想以右图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:
(3)某人设想以右图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:
![]() 。
。

![]()
![]()
(4)若通入SO2的速率为2.24L/min(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,则左侧水的流入速率应为 mL/min
查看答案和解析>>
科目: 来源: 题型:
(10分)如图横坐标为溶液的pH值,纵坐标为Zn2+ 离子或Zn(OH)42-离子(配离子)物质的量浓度的对数,回答下列问题.

(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为 。
(2)从图中数据计算可得Zn(OH)2的溶度积(Ksp)= 。
(3)某废液中含Zn2+ 离子,为提取Zn2+ 离子可以控制溶液中pH值的范围是 。
(4)往1L 1.00 mol?L-1 ZnCl2溶液中加入NaOH固体至pH=6,需NaOH mol (精确到小数点后2位)。
(5)25℃时,PbCl2固体在盐酸中的溶解度如下:
c(HCl)/ (mol?L-1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
103 c(PbCl2)/ (mol?L-1) | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
根据上表数据判断下列说法正确的是 。
![]() A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
![]() B.PbCl2固体在0.50 mol?L-1盐酸中的溶解度小于在纯水中的溶解度
B.PbCl2固体在0.50 mol?L-1盐酸中的溶解度小于在纯水中的溶解度
![]() C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(配离子)
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(配离子)
![]() D.PbCl2固体可溶于饱和食盐水
D.PbCl2固体可溶于饱和食盐水
查看答案和解析>>
科目: 来源: 题型:
(10分)有①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩十种元素,原子序数依次增大,⑨、⑩处于第四周期,其余均为短周期元素。
(1) 若②、⑦、⑧三种元素在周期表中相对位置如下:
② |
|
|
|
|
| ⑦ | ⑧ |
②与⑦、②与⑧形成的液体化合物是常见的重要溶剂,则②、⑦、⑧三种元素最高价氧化物对应的水化物酸性由强到弱的顺序是: (用化学式表示)。
(2)若甲、乙、丙、丁、戊均为上述八种短周期元素中的某些元索组成的单质或由其中两种元素组成的化合物,且甲、戊为无色气体,反应a为置换反应,反应b为化合反应。见右图示转化关系推测:戊可能为: (列举合适的一例)。
 |
![]()
![]()
![]()
![]()
若甲是O2、乙是N2H4,反应a是在强碱性溶液中进行的的原电池反应,则负极发生的电极反应式为:
。
![]() (3)若右下图中A、B、C、D、E分别是上述10种元素中的某些元素组成的单质或其中两种元素组成的化合物.已知:A是常见的金属单质,反应c为置换反应类型。若反应c是用A作电极,在B的水溶液中进行电解反应,它们有如右图示转化关系。则反应d中阴极的电极反应式为:
(3)若右下图中A、B、C、D、E分别是上述10种元素中的某些元素组成的单质或其中两种元素组成的化合物.已知:A是常见的金属单质,反应c为置换反应类型。若反应c是用A作电极,在B的水溶液中进行电解反应,它们有如右图示转化关系。则反应d中阴极的电极反应式为:![]() 。
。
![]() 若反应c是在高温下进行的,且为工业上有重要应用价值的放热反应,当物质C是一种两性化合物,则反应c的化学方程式: 。
若反应c是在高温下进行的,且为工业上有重要应用价值的放热反应,当物质C是一种两性化合物,则反应c的化学方程式: 。
 |
![]()
![]()
![]()
查看答案和解析>>
科目: 来源: 题型:
(12分)铁不能与冷、热水反应,但能与水蒸气反应。资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570 0C 时,生成FeO,高于570 0C时,生成Fe3O4。老师用上图所示实验装置,完成还原铁粉与水蒸气反应的演示实验。
![]() (1)实验中使用肥皂液的作用是 。
(1)实验中使用肥皂液的作用是 。
![]() (2)甲同学为探究实验后试管内的固体含有哪些物质,进行了下列实验:
(2)甲同学为探究实验后试管内的固体含有哪些物质,进行了下列实验:
实验编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管1中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有少量气泡产生 |
② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
根据上述实验,能确定固体中存在的物质是 ;不能确定是否存在Fe3O4的原因是 。
![]() (3)乙同学设计下列实验方案以确定实验后试管内的固体是否存在Fe3O4:
(3)乙同学设计下列实验方案以确定实验后试管内的固体是否存在Fe3O4:
![]() ①溶液X中发生氧化还原反应的离子方程式为 。
①溶液X中发生氧化还原反应的离子方程式为 。

②操作a包括过滤和洗涤,检验沉淀是否已经洗涤干净的操作是 。
③确定是否存在Fe3O4需要测定并记录的实验数据是 。
查看答案和解析>>
科目: 来源: 题型:
向某密闭容器中加入0 .3 molA 、0 .1 molC 和一定量的 B 三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[t0~ t1阶段 c ( B)未画出]。附图乙为 t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件并且所用条件均不同。已知,t3 ~t4阶段为使用催化剂。下列说法正确的是 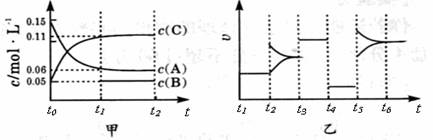
A.若t1=15 s,生成物C在t0~t1时间段的平均反应速率为0.004mol?L-1?s-1
B.t4~t5阶段改变的条件为降低反应温度
C.B的起始物质的量为 0.02mol
D.t5~t6阶段容器内A的物质的量减少0.03 mol,而此过程中容器与外界的热交换总量为akJ,该反应的热化学方程式为3A(g)![]() B(g)+2C(g);ΔH=+100akJ?mol-1
B(g)+2C(g);ΔH=+100akJ?mol-1
查看答案和解析>>
科目: 来源: 题型:
下列溶液中离子浓度的关系一定正确的是
A.在NaHA溶液中一定有:c(Na+) + c(H+) = c(HA-) + c(OH-) + c(A2-)
B.0.2 mo1?L-1 HCl与0.1 mo1?L-1 NaAlO2溶液等体积混合:
c(Cl-)> c(Na+)>c(Al3+)>c(H+)>c(OH-)
C.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
D.pH=3的一元酸HX和pH=11的一元碱MOH等体积混合:
c(M+)=c(X-)>c(H+)=c(OH-)
查看答案和解析>>
科目: 来源: 题型:
(06年江苏卷)阿伏加德罗常数约为6.02×1023mol-1,下列说法中一定正确的是()
A 1.0L 1.0mol?L―1CH3COOH溶液中,CH3COOH分子数为6.02×1023
 B Na2O2与H2O反应生成1.12LO2(标准状况),反应中转移的电子数为2×6.02×1022
B Na2O2与H2O反应生成1.12LO2(标准状况),反应中转移的电子数为2×6.02×1022
C 32g S8单质中含有的S-S键个数为6.02×1023
D 22.4L N2中所含的分子个数为6.02×1023
查看答案和解析>>
科目: 来源: 题型:
水热法制备Fe3O4纳米颗粒反应是3Fe2++2S2O![]() +O2+xOH―
+O2+xOH― Fe3O4+S4O![]() +2H2O,下列说法中,正确的是
+2H2O,下列说法中,正确的是
A.每生成1mol Fe3O4,反应转移的电子总数为4mol B.Fe2+和S2O32―都是还原剂
![]() C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol D.x=2
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol D.x=2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com