
科目: 来源: 题型:
(12分)已知在K2CrO4的溶液中存在着如下的平衡:
(1)浅黄色难溶化合物BaCrO4和过量的硫酸作用后,能产生白色沉淀,则有关的离子方程式为:
(2)向K2Cr2O7溶液中加入Pb(NO3)2并充分搅拌后,溶液的pH明显降低,其原因是:
(3)用0.05mol K2Cr2O7配制成1 L K2CrO4溶液,其中Cr2O72-的浓度小于10-5mol/L。则配制时除K2Cr2O7、H2O外还用到的试剂是:KOH ,溶液的pH应:( ) 8.5 (填大于、等于或小于多少)。
(4)在碱性(c OH- = 1 mol/L)介质中铬和过氧化氢分别有如下的元素电势图:
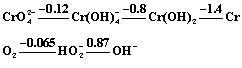
把H2O2写成HO2-的原因是: ; 向KCr(SO4)溶液中,加过量的NaOH和过量的H2O2,则HO2-参与反应的离子方程式为:
查看答案和解析>>
科目: 来源: 题型:
(22分)有机物A、B、C,分子式均为C5H8O2,有关的转化关系如下图所示。A的碳链无支链,且1mol A能与4mol 银氨溶液完全反应。请给出A、B、C、D、E、F、G、H、I的结构简式。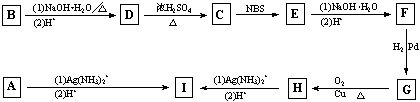
查看答案和解析>>
科目: 来源: 题型:
(8分)经X射线分析鉴定,某一离子晶体属于立方晶系,其晶胞参数a = 403.1 pm。晶胞顶点位置为Ti4+ 所占,体心位置为Ba2+ 所占,所有棱心位置为O2-所占。请据下图回答或计算:
(1) 用分数坐标表达诸离子在晶胞中的位置:
(2) 写出此晶体的化学组成:
(3) 指出晶体的点阵型式、结构基元:
(4) 指出Ti4+ 的氧配位数与Ba2+ 的氧配位数及O2-的配位情况:
(5) 计算两种正离子半径值:
(6) Ba2+ 和O2-联合组成哪种型式堆积:
查看答案和解析>>
科目: 来源: 题型:
请根据等电子原理,将相应物质的化学式填入下列表格的空格中:
CH4 | C2H6 | CO32- | CO2 | C2O42- | CO | CN- | C22- |
NH4+ | N2H62+ | NO3- | NO2+ | N2O4 | N2 | N2 | NO+ |
查得PbI2在水中和在不同浓度(mol/100 g H2O)KI溶液中的溶解度(10-5 mol/100 g H2O)如下表
KI | 0 | 0.030 | 0.060 | 0.100 | 0.150 | 0.200 | 0.250 | 0.300 | 0.350 |
PbI2 | 16.41 | 6.53 | 4.60 | 4.01 | 4.42 | 5.49 | 6.75 | 8.17 | 10.23 |
请说出PbI2溶解度随c(KI) 增大而改变的原因。
查看答案和解析>>
科目: 来源: 题型:
称取2.379 g金属化合物(化学式为MaXb?cH2O),用过量SOCl2(bp
查看答案和解析>>
科目: 来源: 题型:
SO3和NaCl作用生成Cl2被认为是由以下几个反应构成,请分别写出反应方程式
(1)40°C ~100°C,SO3和NaCl生成氯磺酸钠
(2)氯磺酸钠230°C分解生成Na2S2O7、NaCl、SO2、Cl2
(3)400°C Na2S2O7和NaCl反应生成 Na2SO4、SO2、Cl2
(4)总反应式
查看答案和解析>>
科目: 来源: 题型:
次磷酸是强还原剂,加入到CuSO4溶液中,加热到40―50℃,析出红棕色的固体M,经鉴定反应后的溶液是磷酸和硫酸混合物。M的主要性质如下:①60℃以上分解成Cu和一种气体,②可以在Cl2中燃烧,③与盐酸反应放出气体,则M的化学式是
A.Cu2S B.Cu2O
C.Cu3P2 D.CuH
查看答案和解析>>
科目: 来源: 题型:
25℃时浓度都是1 mol?L-1的四种正盐溶液:AX、BX、AY、BY;AX的溶液pH=7且溶液中c(X-)=1 mol?L-1,BX的溶液pH=4,BY的溶液pH=6。下列说法正确的是
A.电离平衡常数KBOH小于KHY
B.AY溶液的pH小于BY的pH
C.稀释相同倍数,溶液pH变化BX小于BY
D.AY溶液的pH小于7
查看答案和解析>>
科目: 来源: 题型:
向2mL 0.5mol/L的FeCl3溶液中加入3mL 3mol/L KF溶液,FeCl3溶液褪成无色,再加入KI溶液和CCl4振荡后静置,CCl4层不显色,则下列说法正确的是
A.Fe3+不与I-发生反应
B.Fe3+与F-结合成不与I-反应的物质
C.F-使I-的还原性减弱
D.Fe3+被F-还原为Fe2+,使溶液中不再存在Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com