
科目: 来源: 题型:
(9分)有一离子晶体经测定属立方晶系,晶胞参数a=4.00Å(1Å=10-8cm),晶胞的顶点位置为Mg2+,体心位置为K+,所有棱边中点为F-。
(1) 该晶体的化学组成是 ;
(2) 晶胞类型是 ;
(3) Mg2+的F-配位数是 ,K+的F-配位数是 ;
(4) 该晶体的理论密度是 g?cm-3。
(5) 设晶体中正离子和负离子互相接触,已知F-的离子半径为1.33Å,试估计Mg2+的离子半径是 Å,K+的离子半径是 Å。
查看答案和解析>>
科目: 来源: 题型:
(6分)已知,CrO42-离子和Cr2O72-离子在水溶液中存在如下平衡:
2CrO42-(aq)+2H+(aq)![]() Cr2O72-(aq)+H2O(1),K=
Cr2O72-(aq)+H2O(1),K=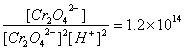
(1) 要使平衡向左移动,可以加 ,或加 ,或加某些金属离子如Ba2+。
(2) 请自行设计两个实验(简单说明实验操作和实验现象)来验证Ba2+确实能使平衡向左移动。
查看答案和解析>>
科目: 来源: 题型:
(12分)Parecoxib为第二代环氧合酶-2(COX-2),由美国Phamarcia公司专为治疗与外科手术或外伤有关的剧烈疼痛而开发,其合成路线如下:
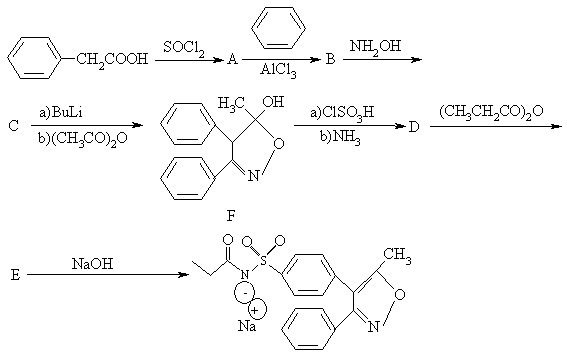 (1) 写出化合物A、B、C、D、E的结构简式:
(1) 写出化合物A、B、C、D、E的结构简式:
A B
C D
E
(2) 用“*”标出化合物F中所有的手性碳,F的光学异构体数目为 。
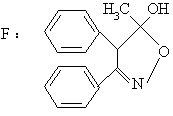
查看答案和解析>>
科目: 来源: 题型:
(13分)高效、低毒农药杀灭菊酯的合成路线如下:
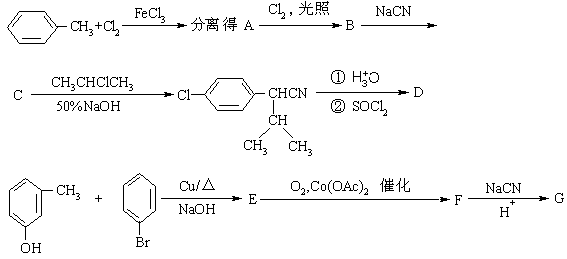
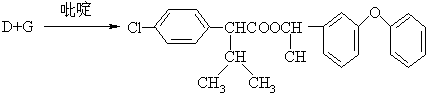
(1) 写出A、B、C、D、E、F、G的结构简式。
A B C
D E
F G
(2) 给出D和G的系统命名。
D G
查看答案和解析>>
科目: 来源: 题型:
(4分)在仅含有Al3+一种金属离子的某样品水溶液中,加入NH3-NH4Ac缓冲溶液,使pH=9.0,然后加入稍过量的8-羟基喹啉,使Al3+定量地生成喹啉铝沉淀:
Al3++3HOC9H6N![]() Al(OC9H6N)3↓+3H+
Al(OC9H6N)3↓+3H+
过滤并洗去过量的8-羟基喹啉,然后将沉淀溶于2mol?L-1HCl溶液中,即得8-羟基喹啉的酸溶液,用15.00mL 0.1238mol?L-1KBrO3-KBr标准溶液(即KBrO3的浓度为0.1238mol?L-1,KBr过量)处理,产生的Br2与8-羟基喹啉发生取代反应为:
HOC9H6N+2Br2![]() HOC9H4NBr2+2H++2Br-
HOC9H4NBr2+2H++2Br-
待取代反应完全以后,再加入过量的KI,使其与剩余的Br2反应生成I2,最后用0.1028mol?L-1 Na2S2O3标准溶液滴定析出的I2,终点时用去Na2S2O3标准溶液5.45mL。
(1) 写出Na2S2O3与I2反应的化学方程式:
。
(2) 由以上实验数据可算得样品中Al的含量为 mg。
查看答案和解析>>
科目: 来源: 题型:
(5分)石墨晶体由如图(1)所示的C原子平面层堆叠形成。有一种常见的2H型石墨以二层重复的堆叠方式构成,即若以A、B分别表示沿垂直于平面层方向(C方向)堆叠的两个不同层次,它的堆叠方式为ABAB……。图(2)为AB两层的堆叠方式,O和●分别表示A层和B层的C原子。
(1) 在图(2)中标明两个晶胞参数a和b。
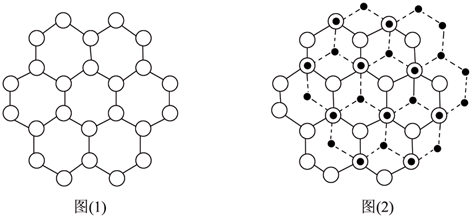
(2) 画出2H型石墨晶胞的立体示意图,并指出晶胞类型。
查看答案和解析>>
科目: 来源: 题型:
(13分)(1) 磷和氢能组成一系列的氢化物,如PH3,P2H4,P12H16等。其中最重要的是PH3。PH3称为膦,它是一种无色剧毒的有类似大蒜臭味的气体。它可由NaOH和白磷反应来制备,其制备反应的化学方程式为 ,P2H4的沸点比PH3 (填“高”或“低”),原因是 。AsH3又称胂,试写出由As2O3制备胂的反应方程式 ,胂的汽化热比膦 (填“大”或“小”)。
(2) ①根据VSEPR理论,SCl3+和ICl4-的空间构型分别是 和 ,S和I分别以 和 杂化轨道同Cl形成共价键。
② SCl3+和PCl3是等电子体,其S-Cl键键长 (填>、=或<)P-Cl键键长,原因是 。
查看答案和解析>>
科目: 来源: 题型:
(12分)(1) 如果已经发现167号元素A,若已知的原子结构规律不变,167号元素应是第 周期、第 族元素;可能的最高氧化态为 ;氢化物的化学式为 。
(2) 某一放射性物质衰变20%需15天,该物质的半衰期是 。
(3) 化合物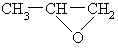 分子中有 种化学环境不同的氢原子。如果用氯取代分子中的氢原子,生成的一氯代物可能有 种。
分子中有 种化学环境不同的氢原子。如果用氯取代分子中的氢原子,生成的一氯代物可能有 种。
(4) 硅与碳为同族元素,呈四价。然而,与碳化合物相比,硅化合物的数量要少得多。碳易于形成双键,硅则不易形成双键。但据美国《科学》杂志2000年报道,已合成了分子中既有Si-Si单键,又有Si=Si双键的化合物X。X的分子式为Si5H6,红外光谱和核磁共振表明X分子中氢原子的化学环境有2种,则X的结构式是: 。
查看答案和解析>>
科目: 来源: 题型:
共11分)2005年1月美国科学家在Science上发表论文,宣布发现了Al的超原子结构,并预言其他金属原子也可能存在类似的结构,这是一项将对化学、物理以及材料领域产生重大影响的发现,引起了科学界的广泛关注。这种超原子是在Al的碘化物中发现的,以13个Al原子或14个Al原子形成Al13或Al14超原子结构,量子化学计算结果表明,Al13形成12个Al在表面,1个Al在中心的三角二十面体结构,Al14可以看作是一个Al原子跟Al13面上的一个三角形的3个Al形成Al―Al键而获得的。文章还指出,All3和All4超原子都是具有40个价电子时最稳定。
(1) 根据以上信息可预测Al13和Al14的稳定化合价态分别为 和 。A114应具有元素周期表中 类化学元素的性质,理由是: 。
(2) 对Al13和A114的Al―Al键长的测定十分困难,而理论计算表明,Al13,和Al14中的Al―Al键长与金属铝的Al―Al键长相当,已知金属铝的晶体结构采取面心立方最密堆积,密度约为2.7g/cm3,请估算Al13和Al14:中Al―Al的键长。
。
(3) Al13三角二十面体中有多少个四面体空隙,假设为正四面体空隙,如果在其中搀杂其他原子,请通过计算估计可搀杂原子的半径最大为多少?
查看答案和解析>>
科目: 来源: 题型:
(共7分) 用钠汞齐还原硝酸钠水溶液可得物质A,用NH2OH和CH3CH2NO2在NaOCH2CH3中反应也可得到物质A,已知A中N的质量分数为26.43%,A是氮的一种不稳定酸B的钠盐,该酸是火箭推进剂的成分。
(1) 试写出上述两个制得A的化学反应方程式。
(2) 试写出B和它的同分异构体的结构。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com