
科目: 来源: 题型:
关于硅的叙法不正确的是 ( )
A.高纯硅是良好的半导体
B.硅是制造太阳能电池的常用材料
C.硅的化学性质不活泼,常温下不与任何物质反应
D.硅在地壳中含量居第二位,但在自然界中没有游离态的硅存在
查看答案和解析>>
科目: 来源: 题型:
下列说法错误的是 ( )
A.原子半径:F<Mg<K B.稳定性:PH3>H2S>NH3
C.酸性:H3PO4<H2SO4<HClO4 D.碱性:Al(OH)3<Mg(OH)2<KOH
查看答案和解析>>
科目: 来源: 题型:
下列有关碱金属的说法中,正确的是 ( )
A.金属锂应保存在煤油中
B.金属钾着火应用泡沫灭火剂更好
C.它们都能在空气里燃烧生成M2O(M表示碱金属)
D.碱金属单质随着核电荷数的递增与水反应的剧烈程度逐渐加剧直至燃烧爆炸
查看答案和解析>>
科目: 来源: 题型:
下列关于浓硝酸和浓硫酸的叙述错误的是 ( )
A.都是常用的干燥剂
B.分别露置在空气中,容器内溶质的物质的量浓度都降低
C.都可以储存于铝制槽罐中
D.和铜反应中都表现出强氧化性和强酸性
查看答案和解析>>
科目: 来源: 题型:
下列关于氯水的叙述正确的是 ( )
A.新制氯水中只含Cl2和H2O分子
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡逸出该气体是Cl2
D.氯水放置数天后PH变大
查看答案和解析>>
科目: 来源: 题型:
下表是某城市空气质量日报公布的部分内容。对表中3个空气质量指标不会产生影响的是 ( )
| 项目 | 空气污染指数(API) | 空气质量级别 | 空气质量描述 |
| 可吸入颗粒物 | 52 | Ⅱ | 良 |
| 二氧化硫 | 7 | I | 优 |
| 二氧化氮 | 24 | I | 优 |
A.焚烧垃圾 B.使用含磷洗衣粉
C.汽车排放的尾气 D.用煤和石油产品作燃料
查看答案和解析>>
科目: 来源: 题型:
![]() 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g),1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
FeO(s)+CO(g),1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
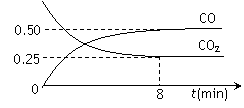 |
|
|
该反应的平衡常数表达式K= 。
⑵下列措施中能使平衡时K增大的是 填序号)。
A.升高温度 B.增大压强
C.充入一定量CO D.再加入一些铁粉
⑶8分钟内,CO的平均反应速率V(CO)= mol/(L·min)。
⑷1100℃时,2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
| 容器 | 甲 | 乙 |
| 反应物投入量 | 3mol Fe、2mol CO2 | 4mol FeO、3mol CO |
| CO的浓度(mol·L | C1 | C 2 |
| CO2的的体积分数 | φ1 | φ2 |
| 体系压强(Pa) | p1 | p2 |
| 气态反应物的转化率 | α1 | α2 |
①下列说法正确的是 。
A.2C1 =3C 2 B.φ1 =φ2 C.p1 <p2 D.α1=α2
②求C1、φ1、α2
过程:
查看答案和解析>>
科目: 来源: 题型:
用中和滴定法测定某烧碱的纯度
(1)配制待测液:将2.0g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成200 mL溶液,所需的主要的玻璃仪器有 (任填两种)。
(2)滴定:
①盛装0.20mol·L-1盐酸标准液应该用 式滴定管。
②滴定时,应先向锥形瓶中加1—2滴 作为指示剂。
③有关数据的记录如下:
| 滴定序号 | 待测液体体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.70 |
| 2 | 20.00 | 6.00 | 25.80 |
| 3 | 20.00 | 1.20 | 21.20 |
| 4 | 20.00 | 2.00 | 34.00 |
(3)纯度计算:烧碱样品的纯度为 。
(4)对几种假定情况的讨论:(填“偏大”“不变”或“偏小”)
①若用蒸馏水冲洗锥形瓶,则会使测定的结果 。
②若在滴定过程中不慎将数滴酸液滴在锥形瓶外则会使测定结果 。
③滴定终了仰视读数,则会是测定结果 。
查看答案和解析>>
科目: 来源: 题型:
称取三份锌粉,分别盛在三只锥形瓶中,按下列要求另加物质后,塞上带导管的塞子,测定生成H2的体积。锥形瓶甲中加入2 mol/L的盐酸10mL,乙中加入2 mol/L的醋酸10mL,丙中加入2 mol/L的醋酸10mL及少量CuSO4粉末。若反应终了,生成H2体积相同,且锌没有剩余。请在小题⑴、⑵中用>、=或<回答:
(1)反应刚开始时甲、乙和丙中反应速率V的大小关系为 。
(2)三只锥形瓶中参加反应的锌的质量m大小关系为 。
(3)简要说明在反应过程中乙、丙中反应的速率不同的理由是 。
(4)为了加快甲反应产生H2的速率采取的下列措施可行的是 。
A.升高温度 B.加入浓硝酸 C.加入醋酸钠晶体 D.加入氯化钠晶体
查看答案和解析>>
科目: 来源: 题型:
(1)25℃时,某NaCl溶液中c(Cl-)=1×10-4 mol/L,则该溶液中c(Na+)∶c(OH-)= 。
(2)常温下,将0.1 mol/L NaOH溶液与0.06mol/L的H2SO4溶液等体积混合(忽略混合后体积的变化),求所得溶液的pH= 。
(3)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11,
①则该温度下水的Kw= 。
②在该温度下测得某溶液pH=3,则该溶液中c(H+)∶c(OH-)=________。
③在此温度下,将pH=12的NaOH溶液VaL与pH=2的H2SO4溶液VbL混合,所得混合液为中性,则Va︰Vb= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com