
科目: 来源: 题型:
铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)所含铁元素既有氧化性又有还原性的物质是 ________(用字母代号填)。
A. Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加1 mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是 ________nm。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:___________________________
______________________________。某校同学为测定FeCl3腐蚀铜后所得溶液的组成,进行了如下实验:
首先取少量待测溶液,滴入KSCN溶液呈红色,则溶液中含有的金属阳离子是_________________________,在此基础上,又进行了定量组成的测定:取50.0mL待测溶液,向其中加入足量的AgNO3溶液,得白色沉淀,过滤、干燥、称量,沉淀质量为43.05 g.溶液中c(Cl-)= mol/L.
(4)若要验证该溶液中含有Fe2+,正确的实验方法是 。
A.向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe2+。
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+。
C.向试管中加入试液,滴入氯水,再滴入KSCN溶液,若显血红色,证明原溶液中含有Fe2+
(5)欲从废水中回收铜,并重新获得FeCl3溶液设计实验方案如下:

A请写出上述实验中加入或生成的有关物质的化学式:
① _____________②____________③______________④________________
B请写出通入⑥的化学方程式__________________________________
查看答案和解析>>
科目: 来源: 题型:
化学计量在化学中占有重要地位,请回答下列问题:
(1)0.3 mol NH3分子中所含原子数与 个H2O分子中所含原子数相等。
(2)含0.4 mol A13+的Al2(SO4)3中所含的SO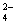 的物质的量是 _____ 。
的物质的量是 _____ 。
(3)已知16 g A和20 g B恰好完全反应生成0.04 mol C和31.76 g D,则C的摩尔质量为 ____________ 。
(4)在一定的温度和压强下,1体积气体X2跟3体积气体Y2化合生成2体积化合物,则该化合物的化学式是______________。
(5)某盐混合溶液中含有离子:Na+、Mg2+ 、Cl-、SO42-,测得Na+、Mg2+ 和Cl-的物质的量浓度依次为: 0.2 mol·L-1、0.25 mol·L-1、0.4 mol·L-1,则
c(SO42-)=___________ 。
查看答案和解析>>
科目: 来源: 题型:
甲同学设计如图所示装置研究氯气能否与水发生反应。
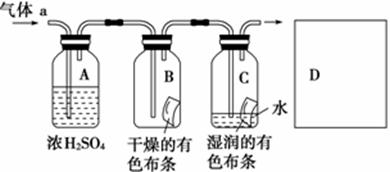
气体a的主要成分是含有少量空气和水蒸气的氯气。请回答下列问题:
(1)浓硫酸的作用是 。
(2)证明氯气和水反应的实验现象为
______________________________________________________________。
(3)从物质性质的方面来看,这样的实验设计存在的缺陷为______________
_____________________________________________,请用离子方程式表达图中D框克服事故隐患的措施_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
实验是进行化学研究的重要手段之一。请回答下列问题:
(1)下列实验操作,正确的是____________________(填写序号)。
a. 称取氢氧化钠固体时,应将氢氧化钠固体直接放在左边托盘内,右边托盘放砝码
b. 用纸槽往试管里装粉末状药品时,试管应先横放再直立
c. 试管、烧杯、量筒、集气瓶都不能用酒精灯直接加热
d. 配制硫酸溶液时,可先在量筒内加入一定体积的水,再在玻璃棒搅拌下慢慢加入浓硫酸
e.闻气体气味时,应取一瓶盛满气体的集气瓶,稍打开玻璃片,用手轻轻扇地在瓶口扇动,使极少量的气体飘进鼻孔,闻气味
(2)实验室需用1000mL 0.1 mol/L标准Na2CO3溶液,请回答下列问题:
①在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器有 _______ 。
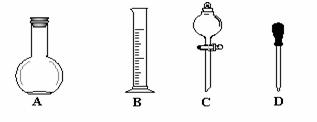
②在容量瓶的使用方法中,下列操作正确的是____________(填写序号)。
a.使用容量瓶前检验是否漏水
b.容量瓶用水洗净后,再用待配溶液洗涤
c.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流注入容量瓶中,然后加蒸馏水。
d.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
③配制1000 mL 0.1 mol·L-1 Na2CO3溶液的实验步骤如下:
a.计算应称取碳酸钠固体的质量为________g。
b.称量碳酸钠固体。
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶。
d.用适量的蒸馏水溶解称量好的碳酸钠固体,冷却。
e.盖好瓶塞,反复上下颠倒,摇匀。
f.继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至凹液面与
刻度线相切。
上述步骤的正确操作顺序为_______________________(用序号表示)。
查看答案和解析>>
科目: 来源: 题型:
向Fe2O3、CuO、Fe、Cu的混和粉末中加入过量的稀硫酸,充分反应后,仍有红色粉末存在,则关于溶液中阳离子的判断正确的是 ( )
A.只有Fe2+和Cu2+ B.一定有Fe2+、Cu2+,可能有Fe3+
C.一定有Fe2+,可能有Cu2+ D.只有Fe2+
查看答案和解析>>
科目: 来源: 题型:
常温下,在溶液中可以发生反应:X + 2Y3+ == X2+ + 2Y2+ ,则下列解释正确的是 ( )
①X被氧化 ②X是氧化剂 ③X具有还原性 ④Y2+是氧化产物 ⑤Y2+具有还原性 ⑥Y3+ 的氧化性比X2+强
A、②⑤ B、②④⑥ C、①③④ D、①③⑤⑥
查看答案和解析>>
科目: 来源: 题型:
氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过反应:Al2O3+N2+3C
 2AlN+3CO合成。下列叙述正确的是 ( )
2AlN+3CO合成。下列叙述正确的是 ( )
A.上述反应中,N2是氧化剂,被氧化。
B.上述反应中,每生成1 mol AlN需转移3 mol电子
C.AlN中氮的化合价为+3
D.AlN的摩尔质量为41 g
查看答案和解析>>
科目: 来源: 题型:
下列说法中,正确的是 ( )
A.标准状况下,1mol任何物质的体积都约为22.4L
B.1mol任何气体所含分子数都相同,体积也都约为22.4L
C.常温常压下,金属Mg从盐酸中置换出1molH2时失去的电子数约为 1.204×1024
D.同温同压下,相同体积的任何气体单质所含原子数目相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com