
科目: 来源: 题型:
生活中难免会遇到一些突发事件,我们要善于利用学过的知识,采取科学、有效的方法保护自己。如果发生了氯气泄漏,以下自救方法得当的是( )
A.只要在室内放一盆水 B.向地势低的地方撤离
C.观察风向,顺风撤离 D.用湿毛巾或蘸有纯碱水的毛巾捂住口鼻撤离
查看答案和解析>>
科目: 来源: 题型:
下列说法中,正确的是 ( )
A.在任何条件下,1mol任何气体的体积都约是22.4L
B.化学的特征就是认识分子和制造分子
C.在化学反应中,反应物的物质的量之和一定等于生成物的物质的量之和。
D.英国科学家道尔顿提出元素周期律,把化学元素及其化合物纳入一个统一的理论体系。
查看答案和解析>>
科目: 来源: 题型:
顺丁橡胶、制备醇酸树脂的原料M以及杀菌剂N的合成路线如下:
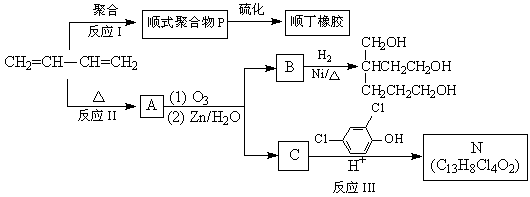
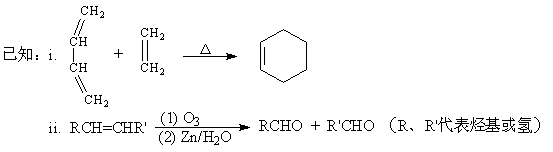
(1)CH2=CH—CH=CH2的名称是________________________。
(2)反应I 的反应类型是(选填字母)_________。 a. 加聚反应 b.缩聚反应
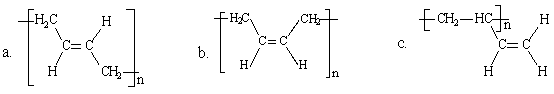 (3)顺式聚合物P的结构式是(选填字母)________。
(3)顺式聚合物P的结构式是(选填字母)________。
(4)A的相对分子质量为108。
①反应II的化学方程式是___________________________________________________。
②1 molB完全转化成M所消耗的H2的质量是_______g。
(5)反应III的化学方程式是___________________________________________________。
(6)A的某些同分异构体在相同的反应条件下也能生成B和C,写出其中一种同分异构体的结构简式____________________________
查看答案和解析>>
科目: 来源: 题型:
锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示:

回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为_ _
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的_______操作.
(3)浸出液“净化”过程中加入的主要物质为________,其作用是__________________。
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体是____
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为____________________。
(6)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于 “升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”该炼锌工艺过程主要反应的化学方程式为____ 。(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)
查看答案和解析>>
科目: 来源: 题型:
2阅读下列A、B、C、D、E、F六种短周期元素的相关信息。
①含A的物质焰色反应为黄色。 ②B的原子最外层电子数是其内层电子数的3倍。③C的最简单离子与Ne原子的电子数相同,且在具有相同电子数的简单离子中离子半径最小。④D与B处于同主族。 ⑤目前人类已知的物质(包括人工制造的物质)中,大多数都含有E元素。 ⑥F元素的某种原子中只有质子,没有中子。请根据上述信息回答问题:
(1)由已知六种元素中的三种组成的易溶于水的物质中,能促进水电离的物质是________(写出一种物质的化学式,下同),能抑制水电离的物质是________。
(2)海水电源主要用于海上航标灯及相类似的海上用电设施,电源利用海水做电解液,空气中的氧做阴极活性物,C的单质作为阳极。写出这种海水电源的正极反应式:
(3)常温下,向体积为1.5 L、浓度为0.1 mol·L-1的A的最高价氧化物对应水化物的水溶液中通入2.24 L(标准状况)EB2气体,待反应充分后,溶液中各离子浓度由大到小的顺序是_______
(4)常温下,向c(H+)=1 mol/L,c(Al3+)=c(Fe3+)=0.04 mol·L-1的溶液中加入A的最高氧化物对应水化物的溶液,以调节溶液的pH(假设溶液体积不变)。那么最先析出的沉淀是____ __(写化学式),刚刚析出沉淀时溶液的pH=______。(已知Ksp[Al(OH)3]=1.3×10-33 mol4·L-4,Ksp[Fe(OH)3]=2.6×10-39 mol4·L-4)
查看答案和解析>>
科目: 来源: 题型:
硫酸镍铵[(NH4) xNiy(SO4)m·nH2O]可用于电镀、印刷等领域。某同学为测定硫酸镍铵的组成,进行如下实验:
①准确称取2.335 0 g样品,配制成100.00 mL溶液A;
②准确量取25.00 mL溶液A,用0.040 00 mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-===NiY2-+2H+),消耗EDTA标准溶液31.25 mL;
③另取25.00 mL溶液A,加足量NaOH溶液并充分加热,生成NH3 56.00 mL(标准状况)。
(1)若滴定管在使用前未用EDTA标准溶液润洗,测得的Ni2+含量将________(填“偏高”“偏低”或“不变”)。
(2)氨气常用 检验,现象是
(3)通过计算确定硫酸镍铵的化学式(写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程。

烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (I)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (II)
S(s)+Na2SO3(aq)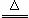 Na2S2O3(aq) (III)
Na2S2O3(aq) (III)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若 ,则整个装置气密性良好。装置D的作用是 。装置E中为 溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为 。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是 。已知反应(III)相对较慢,则烧瓶C中反应达到终点的现象是 。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器含有 。
a .烧杯 b .蒸发皿 c.试管 d .锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩即可析出Na2S2O3•5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论:
已知Na2S2O3•5H2O遇酸易分解:S2O32‾+2H+=S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液
查看答案和解析>>
科目: 来源: 题型:
铜有两种常见的氧化物:CuO和Cu2O。某学习小组取0.98 g Cu(OH)2 固体加热,有铜的氧化物生成,其质量随温度变化如图1所示;另外,某同学绘制了三条表示金属氧化物与其所含金属元素的质量的关系曲线,如图2所示;
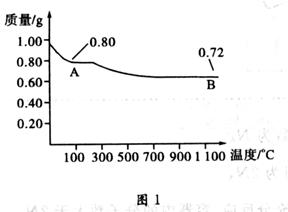
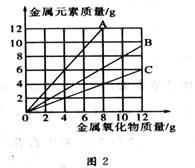
则下列分析正确的是
A.图1中产物A、B的化学式分别为Cu2O和CuO
B.图1整个过程中共生成0.26g水
C.图2三条曲线中,表示CuO和其中所含Cu元素质量关系的曲线是C
D.图1中,A到B过程中有0.01 mol电子发生了转移
查看答案和解析>>
科目: 来源: 题型:
某溶液中可能含有OH—、CO32—、AlO2—、SiO32—、SO42—、HCO3—、Na+、Fe3+、Mg2+、
Al3+ 等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图像如下图所示。下列说法正确的是
A.原溶液中一定含有的阴离子是:OH—、SiO32—、AlO2—、CO32—
B.反应最后形成的溶液中的溶质为NaCl
C.原溶液中一定含有Na2SO4
D.原溶液中含有CO32- 与AlO2- 的物质的量之比为1∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com