
科目: 来源: 题型:
 +2OH-=CaCO3↓+
+2OH-=CaCO3↓+ +H2O
+H2O H3O++S2-
H3O++S2-查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 、
、 中何者能存在于此溶液中:______________
中何者能存在于此溶液中:______________查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
下列各物质的转化关系如下图所示,A是一种高熔点固体,D是一种棕红色固体。
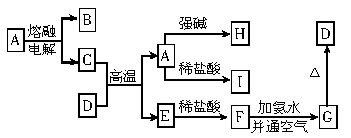
回答下列问题:
(1)填写下列物质的化学式:A______________、D______________。
(2)写出下列反应的化学方程式:
①C+D→A+E:___________________;
②E→F:________________________;
③F→G:________________________。
查看答案和解析>>
科目: 来源: 题型:
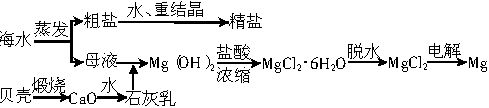
 等杂质,精制后可得到NaCl饱和溶液,精制时通常在溶液中依次加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,最后加入盐酸至溶液呈中性。请写出各步可能发生的反应的离子方程式:___________
等杂质,精制后可得到NaCl饱和溶液,精制时通常在溶液中依次加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,最后加入盐酸至溶液呈中性。请写出各步可能发生的反应的离子方程式:___________查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com