

科目: 来源: 题型:
某化学教师把“钠与氯气反应”的课本实验装置作如下图改进,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,到钠熔融成小球时,撤火,通入氯气,即可见钠着火燃烧,生成大量白烟。以下叙述错误的是( )
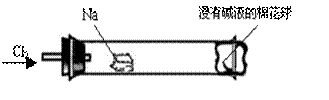
A.反应生成的大量白烟是氯化钠晶体
B.浸有NaOH溶液的棉球用于吸收未反应的氯气,以免污染空气
C.钠着火燃烧产生苍白色火焰
D.用淀粉碘化钾溶液滴在管外的棉球,可以判断氯气是否被完全吸收
查看答案和解析>>
科目: 来源: 题型:
对于下列事实的解释错误的是 ( )
① 蔗糖中加入浓H2SO4后出现发黑现象,说明浓硫酸具有脱水性
② 浓硝酸的颜色变黄,说明浓硝酸见光易分解
③ SO2气体通入溴水使溴水褪色,说明SO2具有漂白性
④ 常温下浓硫酸可用铁槽车储运,说明常温下浓硫酸跟铁不反应
A.①②③④ B.③④ C.只有③ D.只有④
查看答案和解析>>
科目: 来源: 题型:
把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4 X(g)+5 Y(g)=n Z(g)+6 W(g)。2 min 末已生成0.3 mol W,若测知以Z的浓度变化表示的反应速率为0.05 mol?(L?min)-1,试计算(要有过程):
(1)前2 min内用W的浓度变化表示的平均反应速率;
(2)2 min末时Y的浓度;
(3)化学反应方程式中n的值是多少?
查看答案和解析>>
科目: 来源: 题型:
下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
【实验目的】制取乙酸乙酯
【实验原理】甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯。
【装置设计】甲、乙、丙三位同学分别设计了下列三套实验装置:
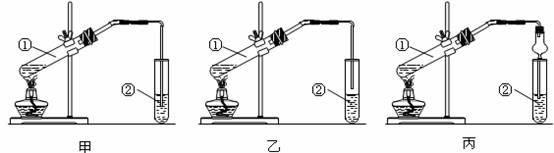
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,较合理的是 (选填“甲”或“乙”)。丙同学将甲装置进行了改进,将其中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是 。
【实验步骤】
(1)按我选择的装置组装仪器,在试管中先加入3 mL乙醇,并在摇动下缓缓加入2 mL浓硫酸充分摇匀,冷却后再加入2mL冰醋酸;(2)将试管固定在铁架上;(3)在试管②中加入适量的饱和Na2CO3溶液;(4)用酒精灯对试管①加热;(5)当观察到试管②中有明显现象时停止实验。
【问题讨论】
a.步骤(1)装好实验装置,加入样品前还应检查 ;
b.写出试管①发生反应的化学方程式(注明反应条件) ;
c.试管②中饱和Na2CO3溶液的作用是 ;
d.从试管②中分离出乙酸乙酯的实验操作是 。
查看答案和解析>>
科目: 来源: 题型:
经研究知Cu2+ 对H2O2分解也具有催化作用,为比较Fe3+ 和Cu2+ 对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
(1)定性分析:如图甲可通过观察 ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3 更为合理,其理由是 ,写出H2O2在二氧化锰作用下发生反应的化学方程式 。
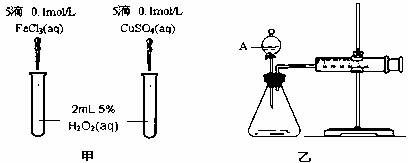
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为 ,实验中需要测量的数据是 。检查乙装置气密性的方法是 。
查看答案和解析>>
科目: 来源: 题型:
通过石油裂解可以获得乙烯,再以乙烯为原料还可以合成很多的化工产品,试根据下图回答有关问题:

(1)有机物 B 的名称为 ,结构简式为 。决定有机物 A、C 的化学特性的原子团的名称分别是 。
(2)写出图示反应①、③的化学方程式,并指明反应类型:
① ;反应类型:
③ ;反应类型:
查看答案和解析>>
科目: 来源: 题型:
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| T | M层上的电子数是原子核外电子层数的2倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(1)元素T在周期表中的位置是处于 周期 族。
(2)元素X的一种同位素可测定文物年代,这种同位素的符号是 。
(3)元素Y与氢元素形成一种分子YH3,写出该微粒的电子式 。
(4)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是__ ___。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(5)T、X、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是
(用化学式表示)。
查看答案和解析>>
科目: 来源: 题型:
设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是( )
A.1mol Mg与足量盐酸反应,转移的电子数为2nA
B.1.5 mol/LMgCl2溶液中Cl- 数目为1.5nA
C.常温常压下,17 g的NH3含有的原子数为4nA
D.标况下,22.4L H2O中所含的分子数为nA
查看答案和解析>>
科目: 来源: 题型:
元素周期表不仅对元素进行了分类,也揭示了一系列的科学观念,如结构决定性质、量变引起质变、复杂现象中蕴涵着简洁的规律等,这对科学的发展等起到了积极的作用。下列说法中正确的是( )
A.在元素周期表中,随着原子序数的递增,原子的半径逐渐减小
B.主族元素原子次外电子层上的电子数与其在元素周期表中的位置有关
C.根据卤族元素砹(At)在元素周期表中位置,可推知HAt受热不易分解
D.水的稳定性比氨的稳定性强,磷酸的酸性比硝酸的酸性弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com