
科目: 来源: 题型:
在pH=1的溶液中能大量共存的一组离子是
A.Na+、Mg2+、ClO—、NO3— B. Al3+、 NH4+、 Br— 、Cl—
C. K+ 、NO2— 、I—、 SO42— D. Na+、K+ 、SiO32—、Cl—
查看答案和解析>>
科目: 来源: 题型:
下列推断合理的是
A.明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂
B.金刚石是自然界中硬度最大的物质,不可能与氧气发生反应
C.浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应
D.将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色
查看答案和解析>>
科目: 来源: 题型:
已知NaBH4是一种强还原剂,其中B元素处于最高价态。解决下列问题:
(1)在60年代,德国拜尔药厂用下面的反应把NaBH4的生产发展成工业规模。请将下列反应方程式配平,各物质的计量数填入相应空格中:
Na2B4O7+ Na+ H2+ SiO2= NaBH4+ Na2SiO3
上述反应中发生氧化反应的物质有 ;
(2)NaBH4极易溶于水并与水反应产生H2,反应后硼以BO2-形式存在,且反应前后硼元素化合价不变,则NaBH4与水反应的离子方程式为_______________;
如果反应中转移2mol电子,则可生成标准状况下的H2为 L;
(3)在碱性条件下NaBH4不与水反应,可使许多金属离子还原成原子,反应后硼仍以 BO2-形式存在。如在冶金工业中,常用NaBH4处理含Au3+的废液。如要处理800kg含Au 1.97%的废液,则理论上需NaBH4的质量___________g。
查看答案和解析>>
科目: 来源: 题型:阅读理解
我国有较长的海岸线,浩瀚的海洋是一个巨大的物质资源和能量的宝库。目前,世界各国都在研究如何充分利用海洋资源。
(1)全球海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg·L-1。其工业提取法有:
Ⅰ、空气吹出纯碱吸收法。方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到单质溴。该方法涉及的反应有:
①_________________(写出离子方程式);
②3Br2+3CO32-=BrO3-+5Br-+3CO2↑;
③_________________(写出离子方程式)。
其中反应②中氧化剂是_________,还原剂是___________
Ⅱ、空气吹出SO2吸收法。该方法基本同⑴,只是将吹出的溴用SO2溶液来吸收,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴。
写出溴与二氧化硫反应的化学方程式 ____________________ 。
Ⅲ、溶剂萃取法。该法是利用单质溴在水中和萃取剂中溶解度的不同的原理来进行的。
实验室中萃取用到的实验仪器名称是 ___________________。
下列可以用于海水中溴的萃取的试剂是 __________。①乙醇,②四氯化碳,③硝酸
 (2)海水中的氘(含HDO 0.03‰)发生聚变的能量,足以保证人类上亿年的能源消费,工业上可采用“硫化氢-水双温交换法”富集HDO。其原理是利用H2S、HDS、H2O和HDO四种物质,在25℃和100℃两种不同温度下发生的两个不同反应得到较高浓度的HDO。
(2)海水中的氘(含HDO 0.03‰)发生聚变的能量,足以保证人类上亿年的能源消费,工业上可采用“硫化氢-水双温交换法”富集HDO。其原理是利用H2S、HDS、H2O和HDO四种物质,在25℃和100℃两种不同温度下发生的两个不同反应得到较高浓度的HDO。
右图为“硫化氢-水双温交换法”所发生的两个
反应中涉及的四种物质在反应体系中的物质的量随温
度的变化曲线。写出100℃时所发生的反应的化学方
程式________________________________________;
工业上富集HDO的生产过程中,可以循环利用的一种
物质是____________________。
查看答案和解析>>
科目: 来源: 题型:
已知X为中学化学中的一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的最高价氧化物是耐火材料;H为气体单质,D为无色气体,在空气中会出现红棕色。各物质的转化关系如下图(部分反应产物已略去)。
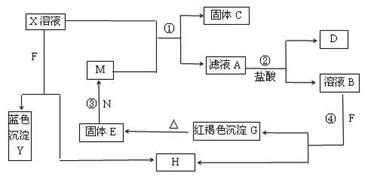
请回答下列问题:
(1)X的化学式为 , F的电子式为
(2)在反应①②③④中属于置换反应的是 (填序号)。
(3)反应②的离子方程式为_______________________________________________。
(4)X溶液与F反应的总化学方程式为 。
(5)若向100 mL盐X的溶液中加入10 g金属单质M的粉末,充分搅拌后,过滤,烘干得10.16g固体C。则滤液A中溶质的物质的量浓度为_____________。(假设溶液体积不变)
查看答案和解析>>
科目: 来源: 题型:
用如下装置可以完成一系列实验(图中夹持装置已略去)。
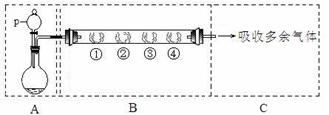
请回答下列问题:
Ⅰ.若用装置A选用浓硫酸和亚硫酸钠固体制取SO2气体(根据需要可以加热),并通过装置B完成表中设计实验,请填写表中空白:
| B中棉花的位置 | ① | ② | ③ | ④ |
| 所蘸试剂 | 石蕊试液 | 品红溶液 | 淀粉和碘水混合液 | 氢硫酸 |
| 现象 | 褪色 | 浅黄色 | ||
| 体现SO2的性质 | 水溶液显酸性 | 漂白性 | 氧化性 |
II.若用装置A选用浓硫酸和浓盐酸混合制取HCl气体,装置B中的四处棉花依次做了如下处理:①包有某固体物质、②蘸有KI溶液、③蘸有石蕊溶液、④蘸有浓NaOH溶液。回答下列问题:
(1)p中盛装试剂的化学式为 。
(2)反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式 。①处包有的某固体物质可能是 。
a.MnO2 b.KMnO4 c.KCl d.Cu
(3)在实验过程中,在③处能观察到 。
(4)反应较长时间后,②处有棕黄色褪去,生成无色的IO3-,写出该反应的离子方程式:
。
查看答案和解析>>
科目: 来源: 题型:
某溶液中可能存在Br-、CO32-、SO32-、Al3+、I-、Mg2+、Na+等7种离子中的几种。现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
据此可以推断:该溶液中肯定不存在的离子组是( )
A.Al3+、Mg2+、I-、SO32- B.Mg2+、Na+、CO32-、I-
C.Al3+、Na+、SO32-、I- D.Al3+、CO32-、Br-、SO32-
查看答案和解析>>
科目: 来源: 题型:
配制一定体积、一定物质的量浓度的溶液时,下列操作会使配得的溶液浓度偏小的是( )
A.容量瓶中原有少量蒸馏水 B.溶液从烧杯转移到容量瓶中后没有洗涤烧杯
C.定容时观察液面俯视 D.滴管加水时,有少量水滴到容量瓶外
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com