
科目: 来源: 题型:
从石英砂制取并获得高纯硅的主要化学反应如下:
① SiO2+2C![]() Si(粗)+2CO
Si(粗)+2CO
② Si(粗)+2Cl2![]() SiCl4
SiCl4
③ SiCl4+2H2![]() Si(纯)+4HCl
Si(纯)+4HCl
关于上述反应的分析不正确的是( )
A.①、③是置换反应,②是化合反应
B.高温下,焦炭与氢气的还原性均强于硅
C.任一反应中,每消耗或生成28 g硅,均转移4 mol电子
D.高温下将石英砂、焦炭、氯气、氢气按一定比例混合可得高纯硅
查看答案和解析>>
科目: 来源: 题型:
波谱分析分析是鉴定有机物分子结构的有效手段。某有机物A经波谱分析有如下信息:质谱显示A的分子离子峰质荷比为94,红外光谱得知A分子中存在C-O键、H-O键、苯环且无其他化学键,A的核磁共振氢谱中有6个吸收峰,峰面积之比为1∶1∶1∶1∶1∶1。回答下列问题:
⑴ A的结构简式为 ;
⑵ 实验室模拟处理含A的工业废水并回收A的流程图如下:
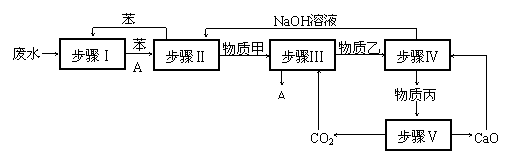
① 步骤Ⅰ中的操作名称是 ,使用的仪器是 ;
② 步骤Ⅱ中NaOH溶液的作用是 ;步骤Ⅲ中的化学反应方程式为 ;
③ 步骤Ⅳ中分离出物质丙的操作名称是 ;
④ 为体现绿色化学思想,上述流程中 是循环使用的。
查看答案和解析>>
科目: 来源: 题型:
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
| 元 素 | Mn | Fe | |
| 电离能 /kJ?mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
回答下列问题:
⑴ Mn元素价电子层的电子排布式为 ,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是 ;
⑵ Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。
① 与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 ;
② 六氰合亚铁离子(Fe(CN)64-)中的配体CN-中C原子的杂化轨道类型是 ,写出一种与CN-互为等电子体的单质分子的路易斯结构式 ;
⑶ 三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为 ;
⑷ 金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如下图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为 。

查看答案和解析>>
科目: 来源: 题型:
一般情况下,较强的氧化剂如:MnO2、KMnO4、KClO3、Ca(ClO)2等氧化浓盐酸时,有如下反应规律:氧化剂+浓盐酸→金属氯化物+水+氯气。实验室通常用该原理制取少量Cl2。
⑴ 从原子经济学角度出发,要使浓盐酸中Cl-充分转化为Cl2,制取等量的Cl2最好选用上述氧化剂中的 氧化浓盐酸。
⑵ 将214.5gCa(ClO)2放入500 mL 、12.0 mol/L的浓盐酸中,生成的Cl2在标准状况下的体积为39.2 L。若反应前后溶液的体积保持不变,计算反应后溶液中HCl的物质的量浓度。
⑶ 漂白粉是 Ca(ClO)2、CaCl2 ?Ca(OH)2 ?H2O 和 CaO 的混合物。漂白粉放出的氯气具有漂白作用,叫有效氯。通常用有效氯表示漂白粉的纯度。漂白粉中的有效氯含量常用滴定碘法进行测定,即在一定量的漂白粉中加入过量的KI ,加H2SO4酸化,有效氯与I-作用析出等量的I2,析出的I2以淀粉指示剂立即用Na2S2O3标准溶液滴定。若测定漂白粉中有效氯时用盐酸酸化,则盐酸的浓度应小于 mol/L,否则测定的有效氯将 (“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
1928年,狄尔斯和阿尔德在研究1,3-丁二烯的性质时发现如下反应:

回答下列问题:
⑴ 下列能发生双烯合成反应的有机物是 (填写序号);
![]()
⑵ 工业上通常以甲醛、乙炔为原料制取1,3-丁二烯,生成流程为:

① 上述流程中甲醛和乙炔的反应类型是 ;
② Y和X是同一系列有机物,两者互为同分异构体,Y能氧化生成一元醛。则Y的结构可能有 种;
⑶ 以CH2=CHCH=CH2、X和HOCH2C≡CCH2OH为原料,合成高分子化合物M的线路如下(羧酸在醇溶液中几乎不和NaOH反应):

① 设置反应①的目的是 ;
② 写出下列反应的化学方程式:B→C ;
③ M的结构简式为 。
查看答案和解析>>
科目: 来源: 题型:
海水中溶解了大量的气体物质和各种盐类。人类在陆地上发现的100多种元素,在海水中可以找到80多种。海洋是一个远未完全开发的巨大化学资源宝库,海洋资源的综合利用具有非常广阔的前景。
回答下列问题:
⑴ 蒸馏法是人类最早使用的淡化海水的方法,技术和工艺比较完备,但由于使用大量燃煤,因此能耗多、排污量大。为克服蒸馏法海水淡化的缺陷,请你对蒸馏法淡化海水的工艺提出一条改进建议 。
⑵ 使用离子交换树脂与水中的离子进行交换也是常用的水处理技术。聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式 。
⑶ 空气吹出法是目前从海水中提取溴的常用方法,流程如下(苦卤:海水蒸发结晶分离出食盐后的母液):
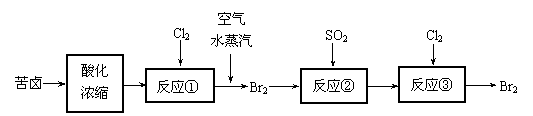
① 反应②的离子方程式为 ;
② 从反应③后的溶液中分离出单质溴的方法是 。
⑷ 苦卤中含有较多的NaCl、MgCl2、KCl、MgSO4等物质。用沉淀法测定苦卤中MgCl2的含量(g/L),测定过程中应获取的数据有 ;
查看答案和解析>>
科目: 来源: 题型:
下图是部分短周期元素的单质和化合物之间的相互转化关系,部分反应中的生成物没有全部列出。A为两性化合物,B、C是常见的非金属单质,D是由两种元素组成的新型陶瓷,F、I、K、W的焰色反应均为黄色,且I是厨房中常用的调味品。X是人类最早合成的有机物。反应③是工业生产重要化工原料W的主要反应。
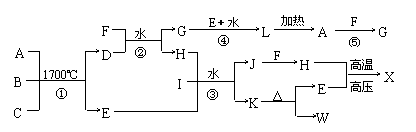
回答下列问题:
⑴ 写出X的分子式 。
⑵ 写出下列反应的离子方程式:反应④ 、反应⑤ 。
⑶ 反应①是工业合成D的方法之一,反应①的化学方程式为 。
⑷ 工业生产中反应③的具体操作是:在I的饱和溶液中先通入H,再通入E。不先通入E的原因是 。
查看答案和解析>>
科目: 来源: 题型:
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g)![]() 3NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:
3NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:
催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。
回答下列问题:
⑴ 合成氨工业中原料气压缩到30~50MPa的原因是 。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是 。
⑵ 500℃、50MPa时,在容积为VL的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x。则K和x的关系满足K= 。
⑶ 甲烷在高温下与水蒸气反应,反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部分物质的燃烧热数据如下表:
| 物 质 | 燃烧热(kJ?mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
已知1mol H2O(g)转变为1mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O在高温下反应的热化学方程式 。
⑷ 有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池。请写出该电池的正极反应式 。
查看答案和解析>>
科目: 来源: 题型:
最近,我国利用生产磷铵排放的废渣磷石膏制取硫酸并联产水泥的技术研究获得成功。具体生产流程如下:

回答下列问题:
⑴ 若操作a、操作b均在实验室进行,则操作a时用到的玻璃仪器有 ;进行操作b时需注意 。
⑵ 装置a用于磷酸吸收NH3。若该过程在实验室中进行,请在下面的方框内画出装置a的示意图。

⑶ 热交换器是实现冷热交换的装置。化学实验中也经常利用热交换来实现某种实验目的,如气、液热交换时通常使用的仪器是 。
⑷ 固体A为生石膏(CaSO4?2H2O)和不含结晶水且高温时也不分解的杂质。生石膏在120℃时失水生成熟石膏(2CaSO4?H2O),熟石膏在200℃时失水生成硫酸钙。为测定固体A中生石膏的含量,某科研小组进行了如下实验:称取固体A 180g置于坩埚中加热,加热过程中固体质量随温度变化记录如下图:
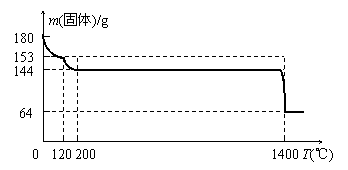
① 实验中每次对固体称量时须在冷却后进行。为保证实验结果的精确性,固体冷却时必须防止 。
②将加热到1400℃时生成的气体通入品红溶液中,品红褪色。
写出1400℃时的化学反应方程式 。
③ 固体A中生石膏的质量百分含量= 。
查看答案和解析>>
科目: 来源: 题型:
Fe2O3、ZnO、CuO的固体混合粉末ag,在加热条件下用足量CO还原,得到金属混合物2.41g,将生成的CO2气体用足量的澄清石灰水吸收后,产生5.00g白色沉淀,则a的数值为( )
A.7.41 B.3.21 C.2.46 D.3.59
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com