

科目: 来源: 题型:
(11分)2008年9月中国的三聚氰胺污染牛奶事件,在社会上造成很坏的影响。已知三聚氰胺中含有碳、氢、氮三种元素,为测定三聚氰胺的组成,用下列各仪器装置,在氧气流中将2.52 克三聚氰胺样品氧化成CO2、H2O和N2。回答下列问题:

(1)产生的氧气按从左向右流向,各仪器装置,各导气管的连接顺序是
g接 、 接 、 接 、 接 。
(2)装置C的作用是 ;
装置E中CuO的作用是 。
(3)实验前后称得A、B两装置的质量分别增加2.64克和1.08克,经计算得出三聚氰胺分子中碳、氢、氮的原子个数比为1:2:2。又已知三聚氰胺的分子量为126,分子中有三个氨基,且有类似苯环的对称结构,则其结构简式为: 。
(4)目前较多采用以尿素【CO(NH2)2】为原料,在0.1mPa下,390℃左右时,以硅胶做催化剂合成三聚氰胺。应过程中除生成CO2外,还生成一种使湿润的红色石蕊试纸变蓝的气体,试写出制备三聚氰胺的化学方程式 。
(5)按(1)的连接方法,此实验装置存在的缺点是 ;
原因是
查看答案和解析>>
科目: 来源: 题型:
(07年广东卷)(10分)二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:

某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥0.42 | ≥2.5 | ≥7 | ≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为________;
(2)滤渣A的主要成分是 。
(3)加入MnS的目的是除去 杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为 。
(5)从废旧碱性锌锰电池中可以回收利用的物质有 (写两种)。
查看答案和解析>>
科目: 来源: 题型:
(10分)有机物A的分子式为C9H10O2,A在光照条件下生成的一溴代物B,可发生如下转化关系(无机产物略):([ O ]指发生氧化反应)
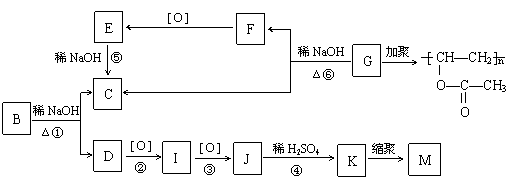
![]()
| |
其中K与FeCl3溶液能发生显色反应,且环上的一元取代物只有两种结构。
已知:① 当羟基与双键碳原子相连时,易发生如下转化:RCH=CHOH à RCH2CHO。
② ―ONa连在烃基上不被氧化。
请回答下列问题:
(1)F与I中具有相同的官能团,检验该官能团的试剂是 。
(2)上述变化中属于水解反应的是 (填编号)。
(3)写出结构简式:G ;
M 。
(4)写出下列反应的化学方程式:
反应① ;
K与过量的Na2CO3溶液反应 。
(5)同时符合下列要求的A的同分异构体有 种。
Ⅰ. 含有苯环
Ⅱ. 能发生银镜反应和水解反应
Ⅲ. 在稀的NaOH溶液中,1mol该同分异构体能与1mol NaOH反应
查看答案和解析>>
科目: 来源: 题型:
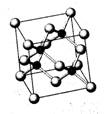 (10分)Ⅰ. 砷化镓为第三代半导体,以其为材料制造的灯泡寿命长、耗能少。已知砷化镓的晶胞结构如图所示。请回答下列问题:
(10分)Ⅰ. 砷化镓为第三代半导体,以其为材料制造的灯泡寿命长、耗能少。已知砷化镓的晶胞结构如图所示。请回答下列问题:
(1)下列说法正确的是__________(填序号)
A.砷化镓晶胞结构与NaCl相同
B.第一电离能 As>Ga
C.电负性 As>Ga
D.原子半径 As>Ga
(2)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的方程式为
_____________________________________________________________;
(3)AsH3空间形状为________________;
已知(CH3)3Ga为非极性分子,则其中镓原子的杂化方式为____________;
Ⅱ. 金属铜的导电性仅次于银,居金属中的第二位,大量用于电气工业。
(4)请解释金属铜能导电的原因 ,
Cu2+的核外电子排布式为__________________________。
(5)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到的[Cu(NH3)4]SO4晶体中含有的化学键除了普通共价键外,还有 和 。
查看答案和解析>>
科目: 来源: 题型:
 (11分)化学兴趣小组同学运用类比学习的思想, 探究过氧化钠与二氧化硫的反应。小组同学改进了右图所示的装置进行实验。充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃。
(11分)化学兴趣小组同学运用类比学习的思想, 探究过氧化钠与二氧化硫的反应。小组同学改进了右图所示的装置进行实验。充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃。
试回答下列问题:
(1)请你完成装置改进的措施和理由:
①措施:在A、B之间加一个干燥管,
理由_______________________________________。
②措施:___________________________________,
理由______________________________________。
(2)某同学推断该白色固体为Na2SO3,则其所类比的化学反应是_____________ (用化学方程式表示)。
任何的推论都要经过检验,请完成对白色固体成分的探究:
限选实验仪器与试剂:烧杯、试管、药匙、滴管、酒精灯、带单孔胶塞的导管、棉花、试管夹;3 mol?L-1HCl、6 mol?L-1HNO3、NaOH稀溶液、蒸馏水、1 mol?L-1 BaCl2 溶液、澄清石灰水、品红溶液。
①提出合理假设:
假设1:白色固体为Na2SO3;
假设2:白色固体为Na2SO3与Na2SO4 的混合物;
假设3: 。
② 设计实验方案证明以上三种假设,并按下表格式写出实验操作步骤、预期现象与结论。
实验操作 | 预期现象与结论 |
步骤1: |
|
步骤2: |
|
… |
|
查看答案和解析>>
科目: 来源: 题型:
(08年海南卷)关于铅蓄电池的说法正确的是()
A.在放电时,正极发生的反应是 Pb(s) +SO42―(aq)= PbSO4(s) +2e―
B.在放电时,该电池的负极材料是铅板
C.在充电时,电池中硫酸的浓度不断变小
D.在充电时,阳极发生的反应是 PbSO4(s)+2e―= Pb(s)+ SO42―(aq)
查看答案和解析>>
科目: 来源: 题型:
(07年广东卷)(11分)已知某混合金属粉末,除铝处还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计合理实验探究该混合物金属粉末中铁、铜元素的存在。
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1mol/L硫酸、2mol/L硝酸、2mol/LNaOH溶液、20%KSCN溶液。
完成以下实验探究过程:
(1)提出假设:
假设1:该混合金属粉末中除铝外还含有 元素;
假设2:该混合金属粉末中除铝外还含有 元素;
假设3:该混合金属粉末中除铝外还含有Fe、Cu元素;
(2)设计实验方案
基于假设3,设计出实验方案(不要在答题卡上作答)。
(3)实验过程
根据(2)的实验方案,叙述实验操作、预期现象和结论。
【提示】Ⅰ.在答题卡上按以下方式作答,注意前后内容对应;
Ⅱ.注意文字简洁,确保不超过答题卡空间。

查看答案和解析>>
科目: 来源: 题型:
(12分)高锰酸钾是深紫色的针状晶体,是最重要也是最常用的氧化剂之一,可用来漂白棉、毛、丝等纺织品。已知温度高于80℃高锰酸钾会部分分解
实验室以软锰矿(主要成份是MnO2)为主要原料来制备高锰酸钾,分两步进行:
第一步是将+4价的锰氧化成为+6价,反应方程式为:
![]()
第二步是在通入CO2条件下使+6价的锰歧化为+7价和+4价(MnO2)。
实验流程如下: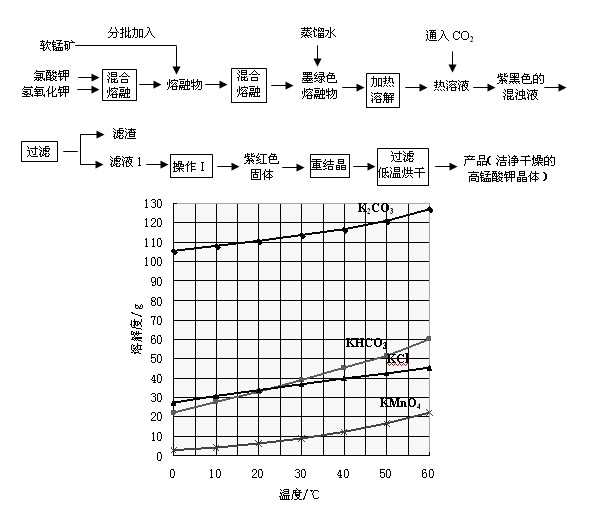
几种物质的溶解度随温度变化如上图所示。回答下列问题:
(1)下列仪器中,混合熔融氯酸钾和氢氧化钾固体过程中需要用到的是
A.蒸发皿 B.玻璃棒 C.铁棒 D.坩埚 E.泥三角 F.烧杯 G.酒精灯 H.铁坩埚
![]()
(2)通入适量二氧化碳,锰酸钾发生岐化反应的化学方程式是
![]()
(3)通入适量的二氧化碳直到锰酸钾全部岐化为止(可用玻璃棒蘸取溶液点于滤纸上,如果滤纸上只有紫红色而无绿色
痕迹,即表示锰酸钾已歧化完全),二氧化碳的通入量不能过多的原因是 。
![]()
(4)操作Ⅰ应该在 (填“加压”、“减压”、“常压”)情况下蒸发,其理由是 。(5)除了酸化可以使锰酸钾发生岐化反应生成高锰酸钾外(歧化法),通过使用惰性电极电解锰酸钾溶液也可以制备高锰酸钾。电解时阴极有气泡产生,则阳极的电极反为 。
与歧化法相比,电解法主要的优点是 。
查看答案和解析>>
科目: 来源: 题型:
(07年广东卷)(8分)“碘钟”实验中,3I-+S2O82-=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:

回答下列问题:
(1)该实验的目的是 。
(2)显色时间t2= 。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为 (填字母)
A <22.0s B 22.0~44.0s C >44.0s D 数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com