
科目: 来源: 题型:
 (11分)沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl + Cl- ==[AgCl2]-, 右图是某温度下AgCl在NaCl溶液中的溶解情况。
(11分)沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl + Cl- ==[AgCl2]-, 右图是某温度下AgCl在NaCl溶液中的溶解情况。
![]()
由以上信息可知:
![]()
(1)由图知该温度下AgCl的溶度积常数为 。
![]()
(2)AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:
![]()
![]()
(3)设计实验证明S(AgCl)>S(AgI)>S(Ag2S),实验方案是
![]()
![]()
(4)若在AgCl形成的浊液中滴加氨水有什么现象?
![]()
发生反应的离子方程式为 。
查看答案和解析>>
科目: 来源: 题型:
(07年天津卷)为达到预期的实验目的,下列操作正确的是()
A.欲配制质量分数为10%的ZnSO4溶液,将l0 g ZnSO4?7H2O溶解在90 g水中
B.欲制备F(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸
C.为鉴别KCl、AICl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量
D.为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用
查看答案和解析>>
科目: 来源: 题型:
(12分)利用天然气合成氨的工艺流程示意如下:
![]()
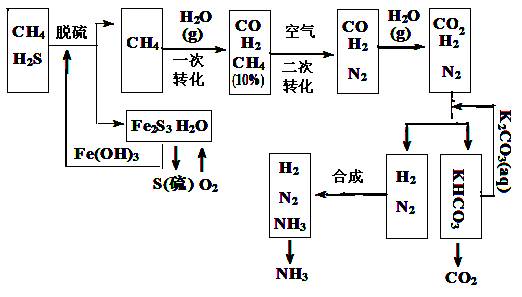
依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是_______________________。
(2)K2CO3(aq)和CO2反应在加压下进行,加压的理论依据是____________(多选扣分)。
(a)相似相溶原理 (b)勒沙特列原理 (c)酸碱中和原理
(3)由KHCO3分解得到的CO2可以用于_______________________(写出CO2的一种重要用途)。
(4)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在下图中标出上述流程图第三处循环(循环方向、循环物质)。
![]()

![]() (5)在一定温度和压强的密闭合成反应器中, H2和N2混合气体平均相对分子质量为8.5,当该反应达到平衡时,测出平衡混合气的平均式量为10,请计算此时H2的转化率(写出计算过程):
(5)在一定温度和压强的密闭合成反应器中, H2和N2混合气体平均相对分子质量为8.5,当该反应达到平衡时,测出平衡混合气的平均式量为10,请计算此时H2的转化率(写出计算过程):
查看答案和解析>>
科目: 来源: 题型:
(13分)某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01 mol?L-1、0.001 mol?L-1, 催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.1 mol?L-1)的用量均为2mL。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
实验编号 | T/K | 催化剂的用量/ g | KMnO4酸性溶液的浓度/mol?L-1 | 实验目的 |
① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响; (Ⅱ)实验①和 探 究温度对该反应速率的影响;
探究催化剂对该反应速率的 影响;) |
② |
|
|
| |
③ |
|
|
| |
④ |
|
|
|
(2)某同学对实验①和②分别进行三次实验,测得以下实验数据(从混合振荡均匀开始计时):
KMnO4酸性溶液
| 溶液褪色所需时间 t / min | ||
第1次 | 第2次 | 第3次 | |
0.01 | 14 | 13 | 11 |
0.001 | 6 | 7 | 7 |
计算用0.001 mol?L-1 KMnO4酸性溶液进行实验时KMnO4的平均反应速率 (忽略混合前后溶液的体积变化,写出计算过程)。
查看答案和解析>>
科目: 来源: 题型:
(07年天津卷)2007年3月21日,我国公布了111号元素Rg的中文名称。该元素名称及所在周期()
A.钅仑 第七周期 B.镭 第七周期 C.铼 第六周期 D.氡 第六周
查看答案和解析>>
科目: 来源: 题型:
(7分)某钠盐溶液可能含有阴离子CO32-、SO32-、SO42-、Cl-、Br-、I 一。为鉴定这些离子,分别取少量溶液进行以下实验:(填写下表空格)
实验操作与预期现象 | 实验结论 | 判断理由 | |
步骤一 | 用pH计测得混合液的pH=9.82 | ① | 因为它们水解显碱性 |
步骤二 | 加 HCl 后,生成无色无味气体。
| ② | ③
|
步骤三 | 在步骤二反应后溶液中加 CCl4,
| 肯定不存在Br-、I- | ④ |
步骤四 | ⑤
| 肯定存在SO42- | 因为BaSO4不溶于盐酸。 |
步骤五 | 在步骤四反应后溶液中加 HNO3 酸化后,再加过量 AgNO3,溶液中析出白色沉淀。 | 不能确定Cl-是否存在 | ⑥ |
查看答案和解析>>
科目: 来源: 题型:
下列溶液中各微粒的浓度关系正确的是
A.0.1 mol•L-1 NaHSO4溶液中:c(Na+)>c(SO42-)>c(H+)>c(OH-)
B.0.1 mol•L-1 Na2S溶液中:2c(Na+) = c(S 2-) + c(HS-) + c(H2S)
C.0.1 mol•L-1 NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的乙酸溶液和氢氧化钠溶液混合后:
c(Na+) = c(CH3COO-) >c(H+) = c(OH-)
查看答案和解析>>
科目: 来源: 题型:
将 4 mol A 气体和 2 mol B 气体在 2 L 的密闭容器中混合并在一定条件下发生如下反应 :
2A(g)+B(g)![]() 2C(g);△H <0
2C(g);△H <0
4 s(秒)后反应达到平衡状态,此时测得 C 的浓度为0.6 mol?L-1 ,下列说法中正确的是
A.反应过程中,当A 、B、C的物质的量浓度之比为 2:1:2时,反应即达到平衡状态
B.4 s 内用物质B表示的反应速率为0.075 mol?L-1?S-1
C.达平衡后若增大压强,A的转化率降低
D.达平衡后若升高温度,C的浓度将减小
查看答案和解析>>
科目: 来源: 题型:
将 4 mol A 气体和 2 mol B 气体在 2 L 的密闭容器中混合并在一定条件下发生如下反应 :
2A(g)+B(g)![]() 2C(g);△H <0
2C(g);△H <0
4 s(秒)后反应达到平衡状态,此时测得 C 的浓度为0.6 mol?L-1 ,下列说法中正确的是
A.反应过程中,当A 、B、C的物质的量浓度之比为 2:1:2时,反应即达到平衡状态
B.4 s 内用物质B表示的反应速率为0.075 mol?L-1?S-1
C.达平衡后若增大压强,A的转化率降低
D.达平衡后若升高温度,C的浓度将减小
查看答案和解析>>
科目: 来源: 题型:
充分利用能源、提高原子利用率、减少向环境排放废弃物等都是“绿色化学”的基本要求。
![]() ① 实验室短时间保存硫酸亚铁溶液时,向试剂瓶中添加铁钉和少量稀硫酸;
① 实验室短时间保存硫酸亚铁溶液时,向试剂瓶中添加铁钉和少量稀硫酸;
![]() ② 用稀硝酸代替浓硝酸溶解、回收做银镜实验后试管内壁的银;
② 用稀硝酸代替浓硝酸溶解、回收做银镜实验后试管内壁的银;
![]() ③ 接触法制硫酸的设备中安装“热交换器”和锅炉,利用余热预热冷原料气和蒸气发电;
③ 接触法制硫酸的设备中安装“热交换器”和锅炉,利用余热预热冷原料气和蒸气发电;
④ 工业合成氨中分离产物得到氢气和氮气再循环使用。
![]() 上述主要从“绿色化学”角度考虑的是
上述主要从“绿色化学”角度考虑的是
![]() A.①②③ B.①②④ C.①③④ D.②③④
A.①②③ B.①②④ C.①③④ D.②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com