

科目: 来源: 题型:
(11分)研究金属的冶炼对人类有重要意义。
(1)人类历史上大量生产和使用铝、铁、钛、铜四种金属单质的时间顺序是____________。
(2)铜的冶炼中有一步是2CuFeS2+4O2=Cu2S+3SO2+2FeO,反应的氧化产物是 。
 (3)右图是部分金属氧化物被一氧化碳还原时lg[p(CO)/p(CO2)]与温度的关系曲线图。则四种金属氧化物中最易被还原的金属氧化物是 ,该反应的△H 0。
(3)右图是部分金属氧化物被一氧化碳还原时lg[p(CO)/p(CO2)]与温度的关系曲线图。则四种金属氧化物中最易被还原的金属氧化物是 ,该反应的△H 0。
(4)下列说法正确是
A.氧化镁跟铝粉共热适于炼镁
B.不锈钢含有金属和非金属元素
C.所有金属均以化合物存在于自然界
D.金属冶炼中还原剂可以是一些活泼金属
E.活泼金属的冶炼都是通过电解其盐溶液制得
F.金属提炼一般要经过矿石的富集、冶炼、精炼三步
(5)为测定某一铁矿石样品中的铁元素的质量分数, 取3.702g该铁矿石(铁以Fe2O3形式存在,其余物质不含铁)溶于浓热盐酸中,稀释至250mL,从中取出25mL溶液,作如下处理:加入过量的氨水,使铁以氢氧化铁的形式沉淀,将沉淀过滤,洗净并灼烧,使之完全转化为氧化铁。有关实验数据:坩埚质量:15.2861g,三次灼烧后坩埚和固体的质量:15.6209g、15.6205g、15.6205g 。则铁矿石中的铁元素的质量分数为__________________(百分数中的数字保留到小数点后一位)。
查看答案和解析>>
科目: 来源: 题型:
(10分)生产氯化锌的主要原料有锌渣等,这些物料含锌30%-70%(其中含有少量的Fe、Cu等硫酸盐),生产工艺流程如图所示(第一次净化含调节pH的过程)。www.ks5.u.com
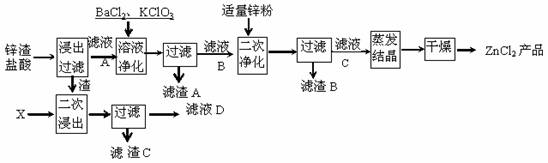
(1)二次浸出时加入的X的化学式是______________,滤液D应该和滤液A、B、C中的滤液 合并。
(2)第一次净化时加入BaCl2的作用是 。
(3)二次净化后过滤得到的滤渣B的主要成分是 。
(4)请用离子方程式表示加入氯酸钾的作用 。
(5)已知SOCl2是液态化合物,沸点是77℃,在盛有10mL水的锥形瓶中小心滴加几滴SOCl2,可观察到反应剧烈,液面上有白雾形成,并逸出刺激性气味的气体。工业上常用ZnCl2?3H2O和SOCl2混合共热来制取无水氯化锌,这种制法可行性的原因是
查看答案和解析>>
科目: 来源: 题型:
(12分)控制变量法是化学实验的一种常用方法,下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据(计算结果精确到小数点后一位):
序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/ ℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
1 | 50.0 | 2.0 | 薄片 | 15 | 200 | m1 |
2 | 50.0 | 2.0 | 薄片 | 25 | 100 | m2 |
3 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m3 |
4 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m4 |
5 | 50.0 | 2.0 | 粉末 | 25 | t1 | 5.0 |
6 | 50.0 | 4.0 | 粉末 | 25 | t2 | m5 |
7 | 50.0 | 6.0 | 粉末 | 25 | t3 | 14.9 |
8 | 50.0 | 8.0 | 粉末 | 25 | t4 | 19.3 |
9 | 50.0 | 10.0 | 粉末 | 25 | t5 | m6 |
10 | 50.0 | 12.0 | 粉末 | 25 | t6 | 19.3 |
分析以下数据,回答下列问题:
(1)实验1和实验2表明,______________对反应速率有影响,对同一规律进行研究的实验还有一组是______________________(填实验序号)。
(2)下列说法正确的是_______
A.t1<70 B. m1<m2 C. m6=19.3 D. t1>t4
(3)本实验还可以研究___________________________对化学反应速率的影响。
(4)硫酸的物质的量浓度是______mol/L, 实验6生成的硫酸锌的质量m5=________g。
查看答案和解析>>
科目: 来源: 题型:
(13分)某研究小组探究MgCl2和AlCl3溶液加入氢氧化钠溶液生成沉淀及沉淀溶解的情况,实验过程中可能用到的仪器与药品如下:
过滤装置,试管,烧杯,滴管,0.5mol/L MgCl2、AlCl3各100mL,酚酞溶液,石蕊溶液,0.1mol/L NaOH溶液,6mol/L NaOH溶液,0.1 mol/L盐酸
探究一:实验开始时产生沉淀的成份
【假设一】实验开始时产生的沉淀是Mg(OH)2
【假设二】
【假设三】实验开始时产生的沉淀是Al(OH)3和Mg(OH)2
基于假设二成立,请利用下表完成实验过程:
www.ks5.u.com
实验步骤 | 预期实验现象 | 预期实验结论 |
|
|
|
|
|
|
|
|
|
探究二:何时产生氢氧化镁沉淀
实验步骤 | 实验现象 | 实验结论 |
①另取0.5mol/L MgCl2、AlCl3溶液各30mL于不同烧杯中 |
|
|
②向0.5mol/L AlCl3溶液中逐滴加入NaOH溶液至刚好反应完全 | 产生沉淀,沉淀增多,沉淀溶解,沉淀消失 | 产生氢氧化铝沉淀,加过量的氢氧化钠溶液后氢氧化铝又溶解。 |
③将MgCl2溶液全部倒入到②反应后的溶液中。 | 产生大量白色沉淀 |
请用离子方程式表示上述实验步骤③的结论
由探究实验一、二分析可知,当向相同浓度的MgCl2、AlCl3混合溶液中滴加氢氧化钠溶液时产生沉淀及沉淀溶解的顺序是 。
查看答案和解析>>
科目: 来源: 题型:
(10分)BaSO4性质稳定,组成与化学式相符,常以BaSO4重量法测定BaCl2?nH2O中的Ba的含量。主要步骤如下:
①在酒精喷灯下灼烧瓷坩埚至恒重,称得坩埚的质量为m g
②称取m1 gBaCl2?nH2O并在烧杯中溶解,加盐酸等作一系列前处理
③将一定浓度的过量硫酸滴入钡盐中得到白色沉淀
④静置,
⑤将沉淀和滤纸置于瓷坩埚中,经酒精喷灯加热碳化后,继续在800-850℃灼烧至恒重,称得坩埚和固体的质量为m2 g
⑥计算
请回答下列问题:
(1)第①步灼烧坩埚后称量前应放在_________冷却,省略第①步中“灼烧瓷坩埚至恒重”可能导致计算结果_______(填“偏高”、“不变”或“偏低”),原因是 。
(2)沉淀钡盐时应加入过量的硫酸,原因是 。
(3)第④步静置后的操作是 。
(4)第⑤步灼烧温度不超过900℃,是因为____________________________________。
查看答案和解析>>
科目: 来源: 题型:
常温下,向加有100mL水的隔热容器中分别加入0.10mol镁粉、0.50mol铁粉及不同物质的量的氯化钠粉末,不断搅拌,实验时分别记录反应过程中0-15min时温度升高的幅度(参见下图),下列说法错误的是

A.NaCl的用量不必大于0.125mol原因是再加入NaCl反而会降低反应速率
B.如果在实验中加入了0.060molNaCl,则第15min时混合物的温度接近于42℃
C.铁粉、NaCl能使反应速率增加,原因是镁粉、铁粉与NaCl的水溶液构成了原电池
D.在其它条件不变下,如果把0.10mol镁粉改成等量的镁条,当加入0.075molNaCl时,纵坐标数值会小于50
查看答案和解析>>
科目: 来源: 题型:
下列比较中,正确的是
A.同温和同物质的量浓度时,HF比HCN易电离,则溶液pH:NaF> NaCN
B.物质的量浓度相等的 H2S 和 NaHS 混合溶液中:2c (Na+) = c (S2) +c (HS)+ c (H2S)
C.0.2 mol•L-l NH4Cl 和 0.l mol•L-l NaOH 溶液等体积混合后:
c (NH4+) > c (Cl) > c (Na+) > c (OH-) > c (H+)
D.将①0.01mol/L的CH3COOH溶液、②0.01mol/L的盐酸、③pH=12的氨水、④pH=12 的NaOH溶液稀释相同倍数后溶液的pH:③>④>①>②
查看答案和解析>>
科目: 来源: 题型:
用电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确的是
A.电解后因消耗了水,c(Na2CO3)变大
B.电池中c(KOH)不变;电解池中溶液pH变大
C.电池的负极反应式为:H2-2e-+2OH-==2H2O
D.当电池负极消耗mg气体时,电解池阳极同时有mg气体生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com