
科目: 来源: 题型:
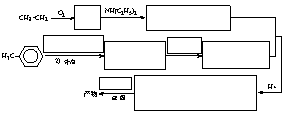
(16分)盐酸普鲁卡因是外科常用药,化学名:对-氨基苯甲酸--二乙胺基乙酯盐酸盐,结构式如右上。作为局部麻醉剂,普鲁卡因在传导麻醉、浸润麻醉及封闭疗法中均有良好药效。它的合成路线如下,请在方框内填入试剂、中间产物或反应条件。
查看答案和解析>>
科目: 来源: 题型:
(12分)在星际云中发现一种高度对称的有机分子(Z),在紫外辐射或加热下可转化为其他许多生命前物质,这些事实支持了生命来自星际的假说。有人认为,Z的形成过程如下:(1)星际分子CH2=NH聚合生成X;(2)X 与甲醛加成得到Y(分子式C6H15O3N3);(3)Y与氨(摩尔比1:1)脱水缩合得到Z 。试写出X、Y和Z的结构简式。
查看答案和解析>>
科目: 来源: 题型:
(10分)曾有人用金属钠处理化合物A(分子式C5H6Br2,含五元环),欲得产物B,而事实上却得到芳香化合物C(分子式C15H18)。
6-1请画出A、B、C的结构简式。
6-2为什么该反应得不到B却得到C?
6-3预期用过量酸性高锰酸钾溶液处理C,得到的产物是D,写出D的结构式。
查看答案和解析>>
科目: 来源: 题型:
(16分)水中氧的含量测定步骤如下:
步骤1:水中的氧在碱性溶液中将Mn2+氧化为MnO(OH)2。
步骤2:加入碘离子将生成的MnO(OH)2再还原成Mn2+离子。
步骤3:用硫代硫酸钠标准溶液滴定步骤2中生成的碘。
有关的测定数据如下:
1:Na2S2O3溶液的标定。取25.00 mL KIO3标准溶液(KIO3浓度:174.8 mg?L-1)与过量KI在酸性介质中反应,用Na2S2O3溶液滴定,消耗12.45 mL。
2:取20.0°C下新鲜水样103.5mL,按上述测定步骤滴定,消耗Na2S2O3标准溶液11.80 mL。已知该温度下水的饱和O2含量为9.08 mg?L-1。
3.在20.0°C下密闭放置5天的水样102.2 mL,按上述测定步骤滴定,消耗硫代硫酸钠标准溶液6.75 mL。
5-1 写出上面3步所涉及的化学反应方程式。
5-2 计算标准溶液的浓度(单位mol?L-1)。
5-3 计算新鲜水样中氧的含量(单位mg?L-1)。
5-4 计算陈放水样中氧的含量(单位mg?L-1)。
5-5 以上测定结果说明水样具有什么性质?
查看答案和解析>>
科目: 来源: 题型:
(12分)市场上出现过一种一氧化碳检测器,其外观像一张塑料信用卡,正中有一个直径不到2cm的小窗口,露出橙红色固态物质。若发现橙红色转为黑色而在短时间内不复原,表明室内一氧化碳浓度超标,有中毒危险。一氧化碳不超标时,橙红色虽也会变黑却能很快复原。已知检测器的化学成分:亲水性的硅胶、氯化钙、固体酸H8[Si(Mo2O7)6]?28H2O、CuCl2?2H2O和PdCl2?2H2O(注:橙红色为复合色,不必细究)。
4-1 CO与PdCl2?2H2O的反应方程式为: 。
4-2 4-1的产物之一与CuCl2?2H2O反应而复原,化学方程式为: 。
4-3 4-2的产物之一复原的反应方程式为: 。
查看答案和解析>>
科目: 来源: 题型:
(12分)铬的化学丰富多采,实验结果常出人意料。将过量30% H2O2加入(NH4)2CrO4的氨水溶液, 热至50oC后冷至0oC,析出暗棕红色晶体A。元素分析报告:A含Cr 31.1%,N 25.1%,H 5.4%。在极性溶剂中A不导电。红外图谱证实A 有N-H键,且与游离氨分子键能相差不太大,还证实A 中的铬原子周围有7个配位原子提供孤对电子与铬原子形成配位键,呈五角双锥构型。
3-1 以上信息表明A 的化学式为: ;可能的结构式为: 。
3-2 A 中铬的氧化数为: 。
3-3 预期A 最特征的化学性质为: 。
3-4 生成晶体A的反应是氧化还原反应,方程式是: 。
查看答案和解析>>
科目: 来源: 题型:
(12分)12.0g含2种化合物(由常见元素组成)的近白色固体溶于过量盐酸, 释放出2.94L气体(标准状态), 气体密度为同温度下空气密度的1.52倍; 剩余的不溶性残渣含氧53.2%,既不溶于酸又不溶于稀碱溶液。通过计算分别写出2种化学物质的化学式。
查看答案和解析>>
科目: 来源: 题型:
(11分) 乙酸在磷酸铝的催化作用下生成一种重要的基本有机试剂A。核磁共振谱表明A分子中的氢原子没有差别;红外光谱表明A分子里存在羰基,而且,A分子里的所有原子在一个平面上。A很容易与水反应重新变成乙酸。回答如下问题:(1)写出A的结构式。(2)写出A与水的反应方程式。(3)写出A与氢氧化钠的反应方程式。(4)写出A与氨的反应方程式,有机产物要用结构式表示。(5)写成A与乙醇的反应方程式,有机产物要用结构式表示。
查看答案和解析>>
科目: 来源: 题型:
(15分) 回答如下几个问题
(1)近期发现不需要外加能源、节约水源而能除去废水中的卤代烷(有碍于人类健康)的方法:把铁放在含卤代烷的废水中,经一段时间后卤代烷“消失”。例如废水中的一氯乙烷经14.9d后就检不出来了。目前认为反应中卤代烷(RCH2X)是氧化剂。写出反应式并说明(按原子)得失电子的关系。
(2) 电解NaCl―KCl―AlCl3熔体制铝比电解Al2O3―Na3AlF6制铝节省电能约30%。为什么现仍用后一种方法制铝?
(3) NH4NO3热分解及和燃料油[以(CH2)n表示]反应的方程式及反应热分别为:
NH4NO3 = N2O + 2H2O + 0.53 kJ/g NH4NO3 …………(1)
NH4NO3 = N2 + 1/2 O2 + 2H2O + 1.47 kJ/g NH4NO3 ………(2)
3n NH4NO3 + (CH2)n = 3n N2 + 7n H2O + n CO2 + 4.29n kJ/g NH4NO3 ……(3)
试问:由以上三个热化学方程式可得出哪些新的热化学方程式?
(4) 参照水溶液化学反应的知识回答下面的问题:在液态BrF3中用KBrF4滴定Br2PbF10,过程中出现电导最低点。写出有关反应式。
查看答案和解析>>
科目: 来源: 题型:
(12分) NO的生物活性已引起科学家高度重视。它与超氧离子(O2― )反应,该反应的产物本题用A为代号。在生理pH值条件下,A的半衰期为1-2秒。A被认为是人生病,如炎症、中风、心脏病和风湿病等引起大量细胞和组织毁坏的原因。A在巨噬细胞里受控生成却是巨噬细胞能够杀死癌细胞和入侵的微生物的重要原因。科学家用生物拟态法探究了A的基本性质,如它与硝酸根的异构化反应等。他们发现,当16O标记的A在18O标记的水中异构化得到的硝酸根有11% 18O,可见该反应历程复杂。回答如下问题:(1)写出A的化学式。写出NO跟超氧离子的反应。这你认为A离子的可能结构是什么?试写出它的路易斯结构式(即用短横表示化学键和用小黑点表示未成键电子的结构式)。(2)A离子和水中的CO2迅速一对一地结合。试写出这种物种可能的路易斯结构式。(3)含Cu+离子的酶的活化中心,亚硝酸根转化为一氧化氮。写出Cu+和NO2在水溶液中的反应。(4)在常温下把NO气体压缩到100个大气压,在一个体积固定的容器里加热到50oC,发现气体的压力迅速下降,压力降至略小于原压力的2/3就不再改变,已知其中一种产物是N2O,写出化学方程式。并解释为什么最后的气体总压力略小于原压力的2/3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com