
科目: 来源:2010-2011学年浙江省高三12月月考化学试卷 题型:选择题
将l1.2g的Mg—Cu混合物完全溶解于足量的硝酸中,收集反应产生的x气体(假定产生的气体全部逸出)。再向所得溶液中加入足量的NaOH溶液,产生21.4g沉淀。根据题意推断气体X的成分可能是( )
A.0.3mol NO2和0.3mol NO B.0.1mol NO、0.2mol NO2 和0.05mol N2O4
C.0.2mol NO2和0.1mol N2O4 D.0.6mol NO
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三12月月考化学试卷 题型:选择题
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是( )
A. 元素A、B组成的化合物常温下一定呈气态
B. 一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应
C. 工业上常用电解法制备元素C、D、E的单质
D. 化合物AE与CE含有相同类型的化学键
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三12月月考化学试卷 题型:选择题
等质量的单质A和化合物B分别和足量水反应产生C、D两种气体单质。一定条件下,产生的C和D两种气体单质恰好可完全反应,则下列判断中正确的是( )
A. A和B的摩尔质量相同
B. 组成A、B的元素均为短周期元素
C. 等质量的A和B所含的质子数相同
D. 等物质的量的A和B与足量水反应产生的气体的体积比为(同温同压下)为2:1
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三12月月考化学试卷 题型:填空题
(1) t℃时Na2SO4的溶解度是S g,其饱和溶液密度d g·cm-3,物质的量浓度为c mol·L-1。向足量饱和溶液中,加入X g无水Na2SO4或蒸发Yg水后恢复t℃,均能获得W g芒硝晶体,下列关系式正确的是 ▲
A. mol·L-1 B.
mol·L-1 B. g
g
C.100X=YS D. g
g
(2)依据事实,写出下列反应的热化学方程式。
已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为 ▲ 。
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三12月月考化学试卷 题型:填空题
有一种稀有气体化合物六铂氟酸氙XePtF6。研究报告指出:“关于XePtF6的电价有Xe2+[ PtF6]2—、Xe+[ PtF6]— 两种可能,巴特列用不可能参加氧化还原反应的五氟化碘作溶剂,将XePtF6溶解,然后在此溶液中加入PbF可得到PbPtF6;加入CsF可得到CsPtF6,这些化合物都不溶于CCl4等非极性溶剂。”试回答:
(1)XePtF6中各元素的化合价分别是 ▲ 、 ▲ 、 ▲ 。
(2)XePtF6是 ▲ (离子、共价)化合物。
(3)写出Xe与PtF6反应生成XePtF6的反应式 ▲ 。而且O2与PtF6可发生类似反应,其反应式是 ▲ 。
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三12月月考化学试卷 题型:填空题
人们对酸碱的认识,已有几百年的历史,经历了一个由浅入深、由低级到高级的认识过程。我们目前中学课本中的酸碱理论是1887年阿仑尼乌斯(Arrhenius)提出了的电离理论。
(1)1905年富兰克林(Franklin)把阿仑尼乌斯以水为溶剂的个别现象,推到任何溶剂,提出了酸碱溶剂理论。溶剂理论认为:凡能离解而产生溶剂正离子的物质为酸,凡能离解而产生溶剂负离子的物质为碱。试写出五氯化磷在某条件下自身电离的方程式:
▲ (一种为正四面体阳离子,另一种为正八面体阴离子)。
(2)1923年丹麦化学家布朗斯物(Brφusted)和英国化学家劳莱(Lowry)提出了质子论。凡是能够释放质子(氢离子)的任何含氢原子的分子或离子都是酸;凡是能与质子(氢离子)结合的分子或离子都是碱。按质子理论:下列粒子在水溶液既可看作酸又可看作碱的是 ▲ 。
A.HSO3- B.NH4+ C.OH- D.HCO3- E.CH3COO- F.Cl-
(3)1923年路易斯(Lewis)提出了广义的酸碱概念。凡是能给出电子对而用来形成化学键的物质是碱;凡是能和电子对结合的物质都是酸。如:
酸(电子对接受体) 碱(电子对给予体) 反应产物
H+
+ [∶OH ]—  H∶OH
H∶OH
试指出下列两个反应中的酸或碱
①H3BO3 + H2O = H+ + B(OH)4- 该反应中的碱是 ▲ (填:H3BO3 或 H2O)
②BF3 + NH3 = BF3 · NH3 该反应中的酸是 ▲ (填:BF3 或 NH3)
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三12月月考化学试卷 题型:填空题
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等, A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子。
请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关):
(1) A~F六种元素原子,原子半径最大的是 ▲ (填序号);
(2)A、C、D三种元素组成的一种常见化合物,是重要的工业产品,该化合物电子式为: ▲ ;
(3)B与F两种元素形成的一种化合物分子,各原子均达八电子结构,其中B显负价,F显正价,则该化合物水解的主要产物是: ▲ ;
(4)用A元素的单质和C元素的单质可制成新型的化学电源,其构造如图所示。2个电极均由多孔性碳制成,通入气体由孔隙中逸出,并在电极表面放电,b电极电流流出。
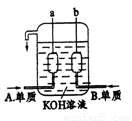
①a是 ▲ 极,电极反应式为 ▲
②b是 ▲ 极,电极反应式为 ▲
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三12月月考化学试卷 题型:实验题
仔细阅读下图,已知B、D、E、F、G是氧化物,其中D是形成酸雨的主要污染物,F、K是氢化物,且F在常温下为液态;C、H是日常生活中最为常见的金属单质,J是气态非金属单质,O是白色沉淀,且B、H、L、M、N、O中含有同种元素(图中部分反应物或产物已略去)。请按要求回答:
(1)反应①既是分解反应,又是氧化还原反应,产物B、D、E、F的物质的量之比1:1:1:14。A强热分解的化学反应方程式为 ▲ 。
(2)写出反应②在工业生产上的一种用途: ▲ 。
(3)反应③的离子方程式为 ▲ ;
反应④的化学方程式为 ▲ 。

查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三12月月考化学试卷 题型:实验题
锂离子电池的广泛应用使回收利用锂资源成为重要课题:某研究性学习小组对废旧锂离子电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)进行资源回收研究,设计实验流程如下:
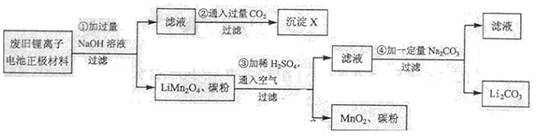
(1)第②步反应得到的沉淀X的化学式为 ▲ 。
(2)第③步反应的离子方程式是 ▲ 。
(3)第④步反应后,过滤Li2CO3所需的玻璃仪器有 ▲ 。
若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:
▲ 、 ▲ 。
(4)若废旧锂离子电池正极材料含LiMn2O4的质量为18.1 g,第③步反应中加入20.0mL 2.5mol·L-1的H2SO4溶液。正极材料中的锂经反应③和④完全转化为Li2CO3,至少有 ▲ g Na2CO3参加了反应。
查看答案和解析>>
科目: 来源:2010-2011学年浙江省高三12月月考化学试卷 题型:实验题
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
制备纳米TiO2的方法之一是TiCl4水解生成TiO2·x H2O,经过滤、水洗除去其中的Cl,再烘干、焙烧除去水分得到粉体TiO2 。
用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+ ,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
⑴ TiCl4水解生成TiO2·x H2O的化学方程式为 ▲ 。
⑵ 检验TiO2·x H2O中Cl-是否被洗净的方法是 ▲ 。
⑶配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是 ▲ ;使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的 ▲ (填字母代号)。
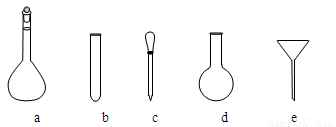
⑷滴定终点的现象是 ▲ 。
⑸滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为 ▲ 。
⑹判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
① 若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果 ▲ 。
② 若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果 ▲
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com