
科目: 来源: 题型:
请完成下面两个小题:
Ⅰ.(6分)反应m A+n B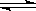 p C在某温度下达到平衡。
p C在某温度下达到平衡。
① 若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是______ _________。
② 若C为气体,且m + n = p,在加压时化学平衡发生移动,则平衡必定向_____方向移动。
③ 如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为_____态。.
Ⅱ.(11分)在一定温度下,在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应:
2X(g)+Y(g)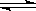 a Z(g)+W(g) ΔH=-Q kJ·mol-1(Q>0)
a Z(g)+W(g) ΔH=-Q kJ·mol-1(Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值是____________(填“增大”、“减小”或“不变”)。
(2)化学计量数a的值为____________(a为整数)。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?____(填“是或否”)其理由是__________________________________。
(4)维持温度不变,能引起c(X)/c(W)减小的操作有( )
A.加入X
B.加入Y
C.增大压强
D.充入He气
(5)X的转化率α=____________(用含Q、Q1的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量。
① 反应的热化学方程式为 。
② 又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ(保留整数)。
③ 此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
查看答案和解析>>
科目: 来源: 题型:
请完成下面两个小题:
Ⅰ.(11分)月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。
(1) 3He是高效核能原料,其原子核内中子数为___________。
(2)Na的原子结构示意图为_______,Na在氧气中完全燃烧所得产物的电子式为______。
(3)MgCl2在工业上应用广泛,可由MgO制备。
①MgO的熔点比BaO的熔点__________(填“高”或”低”)。
②月球上某矿石经处理得到的MgO中含有少量SiO2,SiO2的晶体类型为_________;所含化学键类型为 。
③MgO与碳粉和足量氯气在一定条件下反应可制备MgCl2。若尾气可用足量NaOH溶液完全吸收,则生成的盐有___________________ (写化学式)。
Ⅱ.(13分)X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d 轨道中有9个电子。
请回答下列问题:
(1)Y基态原子的电子排布式是________________;Z所在周期中第一电离能最大的主族元素是_________。
 (2) XY2- 离子的立体构型是_____________:R2+的水合离子中,提供孤电子对的原子是________。
(2) XY2- 离子的立体构型是_____________:R2+的水合离子中,提供孤电子对的原子是________。
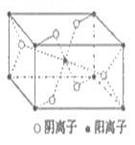
(3)Z与某元素形成的化合物的晶胞如右图所示,晶胞中阴离子与阳离子的个数比是__________。
(4)将R的硫酸盐溶液中通入足量氨气,充分反应后溶液呈
深蓝色,该反应的离子方程式是_____________________________。
查看答案和解析>>
科目: 来源: 题型:
下列说法错误的是( )
A.已知2NO2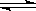 N2O4加压后颜色先变深后变浅。
N2O4加压后颜色先变深后变浅。
B. 在密闭容中发生下列反应aA(g) cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.6倍,故可知A的转化率变小。
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.6倍,故可知A的转化率变小。
C.在密闭容器中进行如下反应:X2(g)+Y2(g) 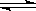 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,Z的浓度有可能是0.4 mol/L。
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,Z的浓度有可能是0.4 mol/L。
D. 未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是⑤⑥⑦⑧。
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大。
B. 恒容容器中平衡体系A(g)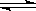 2B(g)中增加A的物质的量,A的转化率增大。
2B(g)中增加A的物质的量,A的转化率增大。
C. 一定条件下反应2AB(g) 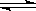 A2(g)+B2(g), 当容器中各组分的体积分数不随时间变化,说明体系达到平衡状态。
A2(g)+B2(g), 当容器中各组分的体积分数不随时间变化,说明体系达到平衡状态。
D. 已知反应A2(g)+2B2(g) 2AB2(g)△H <0, 升高温度,正向反应速率增加,逆向反应速率减小。
2AB2(g)△H <0, 升高温度,正向反应速率增加,逆向反应速率减小。
查看答案和解析>>
科目: 来源: 题型:
在一定温度不同压强(P1<P2)下,可逆反应2X(g) 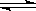 2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是( )
2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是( )
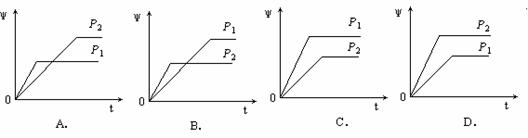
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A. 乙醇燃烧是生成物总能量高于反应物总能量的反应。
B. 稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol可表示稀硫酸与稀Ba(OH)2溶液反应的中和热为ΔH=-57.3 kJ/mol。
C. 2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=―Q kJ/mol可以表示H2S的燃烧热。
D. 高温下,某反应达到平衡,平衡常数为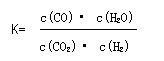
恒容时,温度升高,H2浓度减小,故该反应的焓变为正值。
查看答案和解析>>
科目: 来源: 题型:
二氧化硅晶体是立体的网状结构,其结构如下图所示。关于二氧化硅晶体的下列说法不正确的是( )
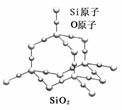
A.晶体中Si、O原子个数比为1∶2。
B.晶体中Si、O原子最外层都满足8电子结构。
C.晶体中一个硅原子含有Si-O键数目为4。
D.晶体中最小环上的原子数为6。
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A. S2-电子排布式 1s22s22p63s23p4
B. 在金属晶体中,自由电子与金属离子或金属原子的碰撞有能量传递,可以用此来解释的金属的物理性质是导热性。
C. 金属键可以看做是许多原子共用许多电子所形成的强烈相互作用,所以和共价键类似,也有饱和性和方向性。
D. 某物质的晶体中含A、B、C三种元素,其排列方式如图所示,晶胞中A、B、C的原子个数比为1∶2∶2。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com