
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
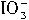 +______I-+_______H+→_______I2+______H2O
+______I-+_______H+→_______I2+______H2O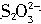 →______I-+______
→______I-+______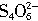
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
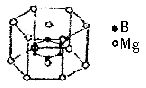
科学家发现了一种在接近40K的温度时成为超导材料的硼镁化合物。这种硼镁超导物质的晶体结构单元如图所示。镁原子间形成正六棱柱,六个硼原子位于棱柱内。
(1)试写出这种超导材料的化学式。
(2)完成并配平下列化学方程式: +HCl→B4H10 +B+H2↑+_________
+HCl→B4H10 +B+H2↑+_________
(3)写出B4H10在空气中燃烧的化学方程式。
(4)假设硼镁超导材料晶体结构中的边长为acm,棱长为bcm,试求此晶体的密度。
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
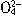 、N
、N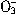 、I-、S2-、H+、K+等离子中的两种或多种。进行如下实验:①取少量溶液并加入铁粉有气体放出。②另取原溶液加入Na2SO3溶液后也有气体放出,且有白色沉淀生成,再加盐酸沉淀不完全消失。③另取原溶液加入AgNO3溶液无沉淀生成。由此判断:(1)原溶液中一定含有的离子是__________________;(2)一定不含的离子是________________;(3)可能含有的离子是______________。
、I-、S2-、H+、K+等离子中的两种或多种。进行如下实验:①取少量溶液并加入铁粉有气体放出。②另取原溶液加入Na2SO3溶液后也有气体放出,且有白色沉淀生成,再加盐酸沉淀不完全消失。③另取原溶液加入AgNO3溶液无沉淀生成。由此判断:(1)原溶液中一定含有的离子是__________________;(2)一定不含的离子是________________;(3)可能含有的离子是______________。查看答案和解析>>
科目: 来源: 题型:
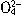 =BaSO4↓+2H2O
=BaSO4↓+2H2O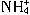 +OH-=NH3↑+H2O
+OH-=NH3↑+H2O
查看答案和解析>>
科目: 来源: 题型:
 =2I-+
=2I-+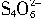
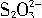 反应)以淀粉为指示剂,终点时溶液由____色变为____色。
反应)以淀粉为指示剂,终点时溶液由____色变为____色。查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com