
科目: 来源: 题型:
A.27 mg B.54 mg C.108 mg D.216 mg
查看答案和解析>>
科目: 来源: 题型:
A.49.2 B.48.1 C.46.5 D.44.9
查看答案和解析>>
科目: 来源: 题型:
①101 kPa时,2C(s)+O2(g)====2CO(g);ΔH=-221kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq) ====H2O(l);ΔH=-57.3kJ·mol-1下列结论正确的是( )
A.碳的燃烧热大于110.5 kJ·mol-1
B.①的反应热为221 kJ·mol-1
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ·mol-1
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量
查看答案和解析>>
科目: 来源: 题型:
A.恒温下加入m g缺角的胆矾晶体,一段时间后,胆矾晶体形状改变但质量不变
B.恒温下加入m g无水硫酸铜,一段时间后,析出晶体的质量大于![]() m g
m g
C.恒温下加入m g无水硫酸铜,析出晶体后,剩余溶液中铜离子的浓度不变
D.蒸发该饱和溶液让其完全结晶,应蒸发到没有液体时才停止加热
查看答案和解析>>
科目: 来源: 题型:
A.Fe2+ B.Mg2+ C. ![]() D.Ba2+
D.Ba2+
查看答案和解析>>
科目: 来源: 题型:
A.78 g Na2O2所含有的离子数为3NA
B.1 mol甲基中含有电子数为10NA
C.7.1 g氯气与足量NaOH溶液反应转移的电子数为0.2NA
D.1 mol C10H22分子中共价键总数为22NA
查看答案和解析>>
科目: 来源: 题型:
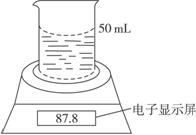
实验时,取一块铁铝合金,将其切成碎块后全部加入到盛有50 mL 5.0 mol·L-1NaOH溶液的烧杯中,试完成下列问题:
(1)合金表面最先产生气泡的位置是_____________(填“切口断面”或“非切口断面”),反应的离子方程式为:________________________________________________________。
(2)合金表面会形成原电池,其负极的电极反应式为:______________________________。
(3)不同时间电子天平的读数如下表所示:
实验操作过程 | 时间/min | 电子天平的读数/g |
烧杯+NaOH溶液 |
| 80.0 |
烧杯+溶液+样品 | 0 | 87.8 |
1 | 87.5 | |
2 | 87.3 | |
3 | 87.2 | |
4 | 87.2 |
则合金中铁的质量分数为(保留三位有效数字,下同)。
(4)上述50 mL NaOH溶液中最多可加入的铁铝合金样品质量为___________。
查看答案和解析>>
科目: 来源: 题型:

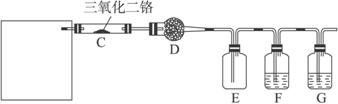
完成下列问题:
(1)实验时,A、C两装置均需加热,应先加热__________装置,原因是_______________;
(2)D装置中应填充的物质是__________,该物质的主要作用是______________________;
(3)E装置的作用是__________,F、G装置中的物质分别是_____________,__________;
(4)若保留上图中黑色粗线框内的装置但去掉通空气的导管B,将C装置中的双孔橡皮塞换成单孔橡皮塞,请你用图示的方法设计一个最简单的实验方案同样完成硝酸的制取(在下面的方框中画出装置图并注明所用药品的名称)。
查看答案和解析>>
科目: 来源: 题型:
①将用分析天平称好的邻苯二甲酸氢钾置于锥形瓶中 ②加适量的蒸馏水溶解,溶液呈无色 ③加入指示剂 ④用NaOH溶液滴定到终点
某学生进行了三次平行实验,实验数据如下:
实验编号 | 邻苯二甲酸氢钾的质量(g) | 待测NaOH溶液的体积(mL) |
1 | 0.612 | 21.20 |
2 | 0.612 | 20.10 |
3 | 0.612 | 19.90 |
试完成下列问题
(1)邻苯二甲酸氢钾与NaOH溶液反应的离子方程式是_______________________________。
(2)所加指示剂最好选用_____________(填“甲基橙”“酚酞”或“石蕊”)判断达到终点的标志是________________________________________________________________。
(3)该同学在进行滴定时,左手应该___________________,右手应该____________________,眼睛应该___________________。
(4)第_________次实验误差较大,造成这种误差的可能原因是( )
A.碱式滴定管在装NaOH溶液前未用待测NaOH溶液润洗2—3次
B.滴定过程中,振荡太剧烈以致有些溶液飞溅出来
C.滴定开始前尖嘴部分有气泡,在滴定终点读数时没有了气泡
D.达到滴定终点时,俯视读数
(5)该同学所“标定”的NaOH溶液的物质的量浓度为_________mol·L-1(结果保留三位数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com