
科目: 来源: 题型:
检验方法 | 沉淀法 | 显色法 | 气体法 |
| 反应中有沉淀产生或溶解 | 反应中有颜色变化 | 反应有气体产生 |
下列离子检验的方法不合理的是
A.![]() :气体法 B.Cl-:沉淀法 C.Al3+:气体法 D.H+:显色法
:气体法 B.Cl-:沉淀法 C.Al3+:气体法 D.H+:显色法
查看答案和解析>>
科目: 来源: 题型:
A.无机物 B.有机物 C.盐类 D.非金属单质
查看答案和解析>>
科目: 来源: 题型:
(1)当加入____________mL NaOH溶液时,可使溶液中的Mg2+和Al3+恰好完全沉淀。
(2)计算合金溶于硫酸时所产生的氢气在标准状况下的体积。
查看答案和解析>>
科目: 来源: 题型:
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是____________(填标号)。
A.碳酸氢钠难溶于水
B.碳酸氢钠受热易分解
C.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
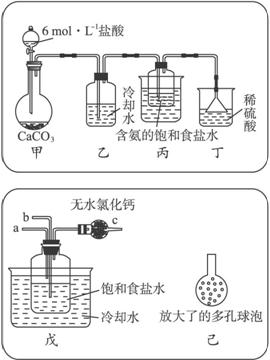
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是____________。
(Ⅱ)丁装置中稀硫酸的作用是__________________________________________________
____________________________________________________________________。
(Ⅲ)实验结束后,分离出NaHCO3晶体的操作是____________(填分离操作的名称)。
②另一位同学用图中戊装置(其他装置未画出)进行实验。
(Ⅰ)实验时,须先从____________管通入____________气体,再从____________管中通入____________气体。
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是____________。
(3)请你再写出一种实验室制取少量碳酸氢钠的方法:_______________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含____________(填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含____________所致。
(3)设计实验并验证:
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
供选用的试剂:a.酚酞试液 b.四氯化碳 c.无水酒精 d.硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
| 选用试剂 | 实验现象 |
方案1 |
|
|
方案2 |
|
|
(4)应用与拓展:
①在足量的稀氯化亚铁溶液中,加入1—2滴溴水,溶液呈黄色所发生的离子反应方程式为____________________________________。
②在100 mL FeBr2溶液中通入
查看答案和解析>>
科目: 来源: 题型:



又知G的分子式为C10H22O3,试回答:
(1)写出B、E的结构简式:B____________,E____________。
(2)反应①—⑤中属于取代反应的有____________。
(3)反应②的方程式为________________________________________________。
(4)反应⑤的方程式为___________________________________________________。
(5)写出I的同分异构体__________________________。
查看答案和解析>>
科目: 来源: 题型:
H2B![]() H++HB- HB-
H++HB- HB-![]() H++B2-
H++B2-
回答下列问题:
(1)Na2B溶液显__________(填“酸性”“中性”或“碱性”)。理由是______________________(用离子方程式表示)。
(2)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是____________。
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+
D.c(Na+)=
(3)已知0.1 mol·L-1 NaHB溶液的pH=2,则0.1 mol·L-1 H2B溶液中氢离子的物质的量浓度可能是____________0.11 mol·L-1(填“<”“>”或“=”),理由是_______________________________。
(4)0.1 mol·L-1 NaHB溶液中各种离子浓度由大到小的顺序是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com