
科目: 来源:2012-2013学年山东省高考重点命题预测系列化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应
B.升高NH4Cl溶液的温度,其水的离子积常数和pH均增大
C.反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的△H<0
D.常温下Ksp(Ag2CrO4)=1.1×10-12,Ksp(AgCl)=1.8×10-10,则Ag2CrO4的溶解度小于AgCl
查看答案和解析>>
科目: 来源:2012-2013学年山东省高考重点命题预测系列化学试卷(解析版) 题型:选择题
下列图示与对应的叙述不相符的是
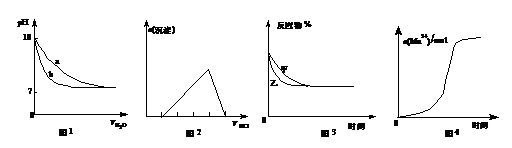
A.图1表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH的变化曲线,其中a表示氨水稀释时pH的变化曲线
B.图2表示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀物质的量与盐酸体积的关系
C.图3表示压强对可逆反应CO(g)+H2O(g)  CO2(g)+H2(g)的影响,乙的压强比甲的压强大
CO2(g)+H2(g)的影响,乙的压强比甲的压强大
D.图4表示10 mL 0.01 mol·L-1 KMnO4 酸性溶液与过量的0.1 mol·L-1 H2C2O4 溶液混合时,n(Mn2+) 随时间的变化(Mn2+对该反应有催化作用)
查看答案和解析>>
科目: 来源:2012-2013学年山东省高考重点命题预测系列化学试卷(解析版) 题型:填空题
多晶硅生产工艺流程如下:
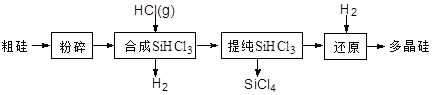
(1)粗硅粉碎的目的是 。分离SiHCl3 (l)和SiCl4(l)的方法为 。
(2)900℃以上, H2与SiHCl3发生如下反应:SiHCl3
(g)+ H2 (g) Si
(s) + 3HCl (g) ΔH >0,其平衡常数表达式为K = 。为提高还原时SiHCl3的转化率,可采取的措施有
。
Si
(s) + 3HCl (g) ΔH >0,其平衡常数表达式为K = 。为提高还原时SiHCl3的转化率,可采取的措施有
。
(3)该流程中可以循环使用的物质是 。
(4)SiCl4与上述流程中的单质发生化合反应,可以制得SiHCl3,其化学方程式为 。
查看答案和解析>>
科目: 来源:2012-2013学年山东省高考重点命题预测系列化学试卷(解析版) 题型:实验题
以钡矿粉(主要成份为BaCO3,含有Ca2+、Fe2+、Fe3+、Mg2+等)制备BaCl2·2H2O的流程如下:

(1)氧化过程主要反应的离子方程式为 。
(2)沉淀C的主要成分是Ca(OH)2和 。
由图可知,为了更好的使Ca2+沉淀,还应采取的措施为 。

(3)用BaSO4重量法测定产品纯度的步骤为:
步骤1:准确称取0.4~0.6 g BaCl2·2H2O试样,加入100 ml 水,3 ml 2 mol·L-1 的HCl溶液加热溶解。
步骤2:边搅拌,边逐滴加入0.1 mol·L-1 H2SO4溶液。
步骤3:待BaSO4沉降后, ,确认已完全沉淀。
步骤4:过滤,用0.01 mol·L-1的稀H2SO4洗涤沉淀3~4次,直至洗涤液中不含Cl-为止。
步骤5:将折叠的沉淀滤纸包置于 中,经烘干、炭化、灰化后在800℃灼烧至恒重。称量计算BaCl2·2H2O中Ba2+的含量。
①步骤3所缺的操作为 。
②若步骤1称量的样品过少,则在步骤4洗涤时可能造成的影响为 。
③步骤5所用瓷质仪器名称为 。滤纸灰化时空气要充足,否则BaSO4易被残留的炭还原生成BaS,该反应的化学方程式为 。
④有同学认为用K2CrO4代替H2SO4作沉淀剂效果更好,请说明原因 。
[已知:Ksp(BaSO4)=1.1×10-10 Ksp(BaCrO4)=1.2×10-10]
查看答案和解析>>
科目: 来源:2012-2013学年山东省高考重点命题预测系列化学试卷(解析版) 题型:填空题
氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等。
(1)已知:N2(g)+2H2(g)=N2H4(l) △H= + 50.6kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
则①N2H4(l)+O2(g)=N2(g)+2H2O(l) △H= kJ·mol-1
②N2(g)+2H2(g)=N2H4(l) 不能自发进行的原因是 。
③用次氯酸钠氧化氨,可以得到N2H4的稀溶液,该反应的化学方程式是 。
(2)采矿废液中的CN- 可用H2O2处理。已知:H2SO4=H++ HSO4- HSO4- H++ SO42-
H++ SO42-
用铂电极电解硫酸氢钾溶液,在阳极上生成S2O82-,S2O82-水解可以得到H2O2。写出阳极上的电极反应式 。
(3)氧化镁处理含NH4+的废水会发生如下反应:
MgO+H2O Mg(OH)2 Mg(OH)2+2NH4+
Mg(OH)2 Mg(OH)2+2NH4+ Mg2+ +2NH3·H2O。
Mg2+ +2NH3·H2O。
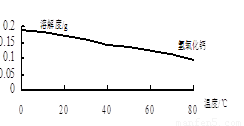
①温度对氮处理率的影响如图所示。在25℃前,升高温度氮去除率增大的原因是 。

②剩余的氧化镁,不会对废水形成二次污染,理由是 。
(4)滴定法测废水中的氨氮含量(氨氮以游离氨或铵盐形式存在于水中)步骤如下:①取10 mL废水水样于蒸馏烧瓶中,再加蒸馏水至总体积为175 mL②先将水样调至中性,再加入氧化镁使水样呈微碱性,加热③用25 mL硼酸吸收蒸馏出的氨[2NH3+4H3BO3=(NH4)2B4O7+5H2O]④将吸收液移至锥形瓶中,加入2滴指示剂,用c mol·L-1的硫酸滴定至终点[(NH4)2B4O7+H2SO4+5H2O=(NH4)2SO4+4H3BO3],记录消耗的体积V mL。则水样中氮的含量是 mg·L-1(用含c、V的表达式表示)。
查看答案和解析>>
科目: 来源:2012-2013学年江苏省南京市、盐城市高三年级第一次模拟考试化学试卷(解析版) 题型:选择题
化学在绿色发展、循环发展、低碳发展及推进生态文明建设中正发挥着积极作用,下列做法与可持续发展宗旨相违背的是
A.加大清洁能源的开发利用,提高资源的利用率
B.推广碳捕集和储存技术,逐步实现二氧化碳零排放
C.加大铅酸蓄电池、含汞锌锰干电池的生产,满足消费需求
D.对工业废水、生活污水净化处理,减少污染物的排放
查看答案和解析>>
科目: 来源:2012-2013学年江苏省南京市、盐城市高三年级第一次模拟考试化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.中子数为18的硫原子: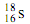
B.COCl2的电子式: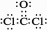
C.Al3+的结构示意图: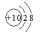
D.聚丙烯的结构简式: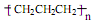
查看答案和解析>>
科目: 来源:2012-2013学年江苏省南京市、盐城市高三年级第一次模拟考试化学试卷(解析版) 题型:选择题
下列实验现象可用同一原理解释的是
A.品红溶液中分别通入SO2和Cl2,品红均褪色
B.溴水分别滴入植物油和裂化汽油中,溴水均褪色
C.鸡蛋白溶液中分别加入NaCl溶液和HgCl2溶液,均有固体析出
D.分别加热盛有NH4Cl和单质碘的试管,管口均有固体凝结
查看答案和解析>>
科目: 来源:2012-2013学年江苏省南京市、盐城市高三年级第一次模拟考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.能溶液Al2O3的溶液:Na+、K+、HCO—3、NO—3
B.0.1mol·L-1Ca(ClO)2溶液:K+、Na+、I—、Cl—
C.能使甲基橙显红色的溶液:K+、Fe2+、Cl—、NO—3
D.加入KSCN显红色的溶液:Na+、Mg2+、Cl—、SO2—4
查看答案和解析>>
科目: 来源:2012-2013学年江苏省南京市、盐城市高三年级第一次模拟考试化学试卷(解析版) 题型:选择题
下列有关物质的性质与其应用不相对应的是
A.Al具有良好延展性和抗腐蚀性,可制成铝箔包装物品
B.NaHCO3能与碱反应,食品工业用作焙制糕点的膨松剂
C.NH3能与Cl2生成NH4Cl,可用浓氨水检验输送氯气的管道是否有泄漏
D.K2FeO4能与水作用生成Fe(OH)3胶体和O2,可用于净化自来水并杀菌消毒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com