
科目: 来源:期中题 题型:单选题
查看答案和解析>>
科目: 来源:山东省期中题 题型:单选题
 2H I(g)ΔH=–26.48kJ/mol①
2H I(g)ΔH=–26.48kJ/mol①  2H I(g)ΔH=+9.48kJ/mol ②
2H I(g)ΔH=+9.48kJ/mol ② 查看答案和解析>>
科目: 来源:山东省期中题 题型:填空题
查看答案和解析>>
科目: 来源:浙江省期中题 题型:单选题
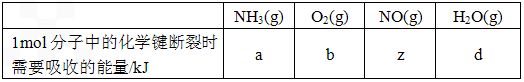
查看答案和解析>>
科目: 来源:湖南省期末题 题型:填空题
 H=-570kJ/mol ;
H=-570kJ/mol ; H=-242kJ/mol
H=-242kJ/mol  H= -110.5kJ/moL
H= -110.5kJ/moL  H=-393.5kJ/moL
H=-393.5kJ/moL  H= +890kJ/moL
H= +890kJ/moL  H=akJ/moL;则a= ; 又已知自由能
H=akJ/moL;则a= ; 又已知自由能 G=
G= H-T
H-T S,当
S,当 G<0时可自发进行。则该反应在什么条件下可自发进行 。
G<0时可自发进行。则该反应在什么条件下可自发进行 。查看答案和解析>>
科目: 来源: 题型:
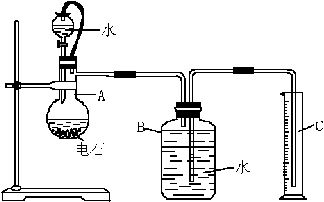
查看答案和解析>>
科目: 来源:不详 题型:问答题
| 高温 |
| 高温 |
| 高温 |
| O | 2-3 |
| O | 2-4 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| 1 |
| 2 |
| 1 |
| 2 |
| A.-285.8 kJ/mol | B.-339.2 kJ/mol |
| C.-1370 kJ/mol | D.+339.2 kJ/mol |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| 1 |
| 2 |
| A.CO的燃烧热为283 kJ |
| B.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| C.25℃、101 kPa下,Na2O2(s)+2Na(s)═2Na2O(s) H=-317 kJ/mol |
| D.Na2O 和Na2O2阴阳离子个数比不相等 |
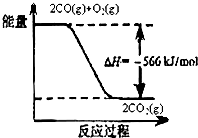
查看答案和解析>>
科目: 来源:不详 题型:问答题
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com