
科目: 来源:专项题 题型:单选题
[ ]
查看答案和解析>>
科目: 来源:专项题 题型:单选题
[ ]
查看答案和解析>>
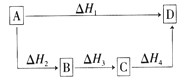
科目: 来源:0118 月考题 题型:单选题
[ ]
查看答案和解析>>
科目: 来源:0112 月考题 题型:填空题
查看答案和解析>>
科目: 来源:0106 期中题 题型:单选题
[ ]
 O2(g)=CO2(g)+CO(g)+4H2O(g) ΔH=-1038 kJ·mol-1
O2(g)=CO2(g)+CO(g)+4H2O(g) ΔH=-1038 kJ·mol-1  O2(g)=CO2(g)+CO(g)+4H2O(l) ΔH=-1214 kJ·mol-1
O2(g)=CO2(g)+CO(g)+4H2O(l) ΔH=-1214 kJ·mol-1 查看答案和解析>>
科目: 来源:宁夏自治区高考真题 题型:单选题
[ ]
查看答案和解析>>
科目: 来源:模拟题 题型:单选题
查看答案和解析>>
科目: 来源:0107 月考题 题型:单选题
[ ]
查看答案和解析>>
科目: 来源:0115 月考题 题型:填空题
 CO2(g) (1mol碳单质反应放热Q1 kJ)
CO2(g) (1mol碳单质反应放热Q1 kJ) CO(g)+H2(g) (1mol碳单质反应吸热Q2 kJ)
CO(g)+H2(g) (1mol碳单质反应吸热Q2 kJ)  2CO2(g)
2CO2(g) 2H2O(g) (1molCO和1molH2反应共放热Q3 kJ)
2H2O(g) (1molCO和1molH2反应共放热Q3 kJ) 查看答案和解析>>
科目: 来源:0127 期末题 题型:填空题
 O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com