
科目: 来源: 题型:阅读理解
某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:一是发生氧化还原反应:2Fe3++SO32-=2Fe2++SO42-+2H+;二是发生双水解反应:
2Fe2++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3。为了弄清是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
实验Ⅰ 实验用品Na2SO3浓溶液、BaC12稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,实验者设计这个实验目的是 。
实验Ⅱ 取5mL FeC13浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色物质是 。向红褐色物质中逐滴加入稀盐酸至过量,可以观察到的现象是 。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为 。另一份加入BaC12稀溶液,有少量白色沉淀的离子方程式是 。
实验Ⅲ 换用稀释FeC13和Na2SO3溶液重复实验Ⅱ,产生的现象完全相同。由上述实验得出的结论是 。若FeC13浓溶液中加入Na2CO3浓溶液,观察到产生红褐色沉淀和无色气体,该反应的离子反应方程式是 。从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,两者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:① ;② 。
查看答案和解析>>
科目: 来源: 题型:
下图中每一方框内的字母代表一种反应物或生成物。已知:C、D、F是常见的气体,D可用于焊接和切割金属,J是生活中常见的一种塑料的主要成分,H可用于漂白和消毒杀菌。
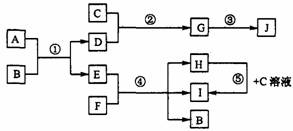
请填空:
(1)A的晶体中存在的化学键: ,D的结构简式: 。
(2)反应③的化学方程式: 。反应⑤的离子方程式: 。
(3)H在空气中变质的化学反应方程式: 。
(4)D、F两种气体在水下相遇,立即闪现明亮火球并有大量浓黑的烟絮上升,水溶液呈强酸性。若该反应产生1.2g黑色单质时放热51.65kJ,则反应的热化学方程式为
。
查看答案和解析>>
科目: 来源: 题型:
下图表示各物质之间的转化关系(部分反应物没有给出)。
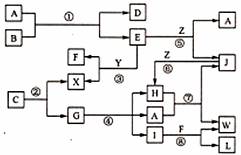
已知:
Ⅰ.A是无色液体,L是不溶于稀硝酸的白色沉淀,E、F、H、J、X、Y、Z是气体;
Ⅱ.G、X、Y、Z是单质,其他是化合物,其中Y呈黄绿色,H呈红棕色,E和F都极易溶于水,两者相遇有白烟生成;
Ⅲ.B和C都是由一种金属与一种非金属元素组成的化合物,其中非金属元素相同且质量分数都是28%,组成B金属元素原子核外的K层和M层电子数相同。
请按要求填空:
(1)写出下列物质A的电子式 ,X的结构式 ;
(2)工业上制取硝酸的反应有(填写反应代号): ;
(3)写出下列物质的化学式:B ,C ;
(4)反应④的化学方程式为: 。
(5)保持容器的温度和体积不变,在反应③刚好完全发生时,反应前后容器的压强之比为 。
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A.白磷晶体中,微粒之间通过共价键结合,键角60℃
B.由主族元素构成的某离子化合物中,一个阳离子和一个阴离子核外电子数之和为20。晶体中阳离子和阴离子个数一定相等
C.(NH4)2PtC16晶体受热分解,生成氮气、氯化氢、氯化氨和金属铂。在此反应中,氧化产物与还原产物的物质的量之比为4:3
D.向NaOH溶液中滴加同浓度的少量Ca(HCO3)2―溶液,其离子方程式为:
Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
查看答案和解析>>
科目: 来源: 题型:
常温下,甲、乙均为1L 0.1mol/L氨水,其pH为11。
①甲用蒸馏水稀释100倍后,溶液的pH=a
②乙与1L 0.2mol/L盐酸混合,在混合溶液中:n(NH+4)+n(H+)-n(OH―)=b mol。则a、b正确的组合是( )
A.9―10之间、0.1 B.9―11之间、0.2
C.12―13之间、0.2 D.13、0.2
查看答案和解析>>
科目: 来源: 题型:
根据元素周期律及晶体结构与性质判断,下列各项叙述中正确的组合是( )
①同一主族元素,原子半径越大,非金属单质的熔点一定越高
②同一周期元素的原子,半径越大越容易失去电子
③同一主族元素的氢化物,相对分子质量越大,它的沸点一定越高
④若X是原子晶体,Y是分子晶体,则熔点:X>Y
⑤若A2+2D―=2A―+D2,则还原性:D―>A―
⑥若R2―和M+的电子层结构相同,则原子序数:R>M
⑦若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性:NaA<NaB
⑧VIA族元素的氢化物中稳定性最好的,其沸点也最高
A.①③⑤⑦ B.②④⑥⑧ C.①②③④⑥⑦⑧ D.①②④⑤⑦⑧
查看答案和解析>>
科目: 来源: 题型:
某有机物分子中含有n个―CH2―、m个―C―、a个―OH,其余为甲基。则甲基的数
|
A.m+2-a B.n+m+a C.2n+3m-a D.m+2n+2-a
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A.标准状况下22.4L辛烷完全燃烧,生成二氧化碳分子为8NA(NA代表阿伏加德罗常数值)
B.镁、铝制造的容器可用来盛放浓HNO3,镁、铝都能与强碱溶液反应放出氢气
C.除去乙醇中少量的乙酸:加足量生石灰,蒸馏
D.钢铁在潮湿空气中发生电化学腐蚀时,正极发生的主要反应是2H2O+O2-4e―=4OH―
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com