相关习题
0 95377 95385 95391 95395 95401 95403 95407 95413 95415 95421 95427 95431 95433 95437 95443 95445 95451 95455 95457 95461 95463 95467 95469 95471 95472 95473 95475 95476 95477 95479 95481 95485 95487 95491 95493 95497 95503 95505 95511 95515 95517 95521 95527 95533 95535 95541 95545 95547 95553 95557 95563 95571 203614
科目:
来源:海门市2007学年第一学期高三第一次诊断考试、化学试卷
题型:022
|
|
能源是人类社会发展进步的物质基础.在当代,能源同信息、材料一起构成了现代文明的三大支柱.
| (1) |
|
为了降低汽车尾气对大气的污染,江苏有关部门拟用甲醇替代液化石油气作为公交车的燃料.已知:在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ.请写出表示甲醇燃烧热的热化学方程式.________
|
|
(2) |
|
测定工业甲醇中CH3OH的质量分数可按下法:取0.1000g工业甲醇样品,以适量H2SO4酸化后,加入20.00mL0.2000mol/L的K2Cr2O7溶液,再用0.3000mol/L(NH4)2Fe(SO4)2标准溶液滴定,耗去此标准液20.00mL时,刚好到达滴定终点.
已知:CH3OH+Cr2O72-+8H+=CO2↑+2Cr3++6H2O
①写出H2SO4酸化的K2Cr2O7溶液与(NH4)2Fe(SO4)2溶液反应的离子方程式.________
②求此工业甲醇中CH3OH的质量分数.
|
|
|
查看答案和解析>>
科目:
来源:海门市2007学年第一学期高三第一次诊断考试、化学试卷
题型:022
|
|
化学键的键能是指气态原子间形成1mol化学键时释放的能量.如:
H(g)+I(g)→H-I(g)+297KJ即H-I键的键能为297KJ·mol-1,也可以理解为破坏1molH-I键需要吸收297KJ的热量.化学反应的发生可以看成旧化学键的破坏和新化学键的形成.
下表是一些键能数据.(单位:KJ·mol-1)
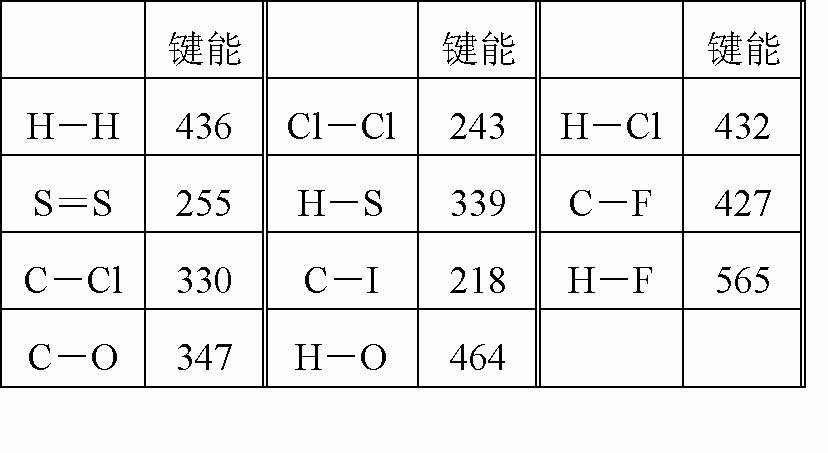
阅读上述信息,回答下列问题:
| (1) |
|
根据表中数据判断CCl4的稳定性________(填“大于”或“小于”)CF4的稳定性.试预测C-Br键的键能范围________<C-Br键能<________.
|
|
(2) |
|
结合表中数据和热化学方程式H2(g)+Cl2(g)=2HCl(g)ΔH=—QKJ/mol;通过计算确定热化学方程式中Q的值为________.
|
|
(3) |
|
卤代烃RX在同样条件下发生碱性水解反应时,RF、RCl、RBr、RI(R相同)的反应活性由大到小的顺序是________.
|
|
(4) |
|
有人认为:H-O键的键能大于H-S键的键能,所以H2O的熔沸点高于H2S的熔沸点.你是否赞同这种观点?如不赞同,请说出你的解释.________.
|
|
|
查看答案和解析>>
科目:
来源:海门市2007学年第一学期高三第一次诊断考试、化学试卷
题型:022
|
|
将2molI2(g)和1molH2置于某2L密闭容器中,在一定温度下发生反应:
I2(g)+H2(g) 2HI(g);△H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线(II)所示. 2HI(g);△H<0,并达平衡,HI的体积分数ω(HI)随时间变化如图曲线(II)所示.

| (1) |
|
达平衡时,I2(g)的物质的量浓度为________.
|
|
(2) |
|
若改变反应条件,在甲条件下ω(HI)的变化如图曲线(I)所示,在乙条件下ω(HI)的变化如图曲线(III)所示.则甲条件可能是________(填入下列条件的序号.下同),乙条件可能是________.
①恒温条件下,扩大反应容器体积
②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积
④恒容条件下,升高温度
⑤恒温恒容条件下,加入适当催化剂
|
|
(3) |
|
若保持温度不变,在另一相同的2L密闭容器中加入amolI2(g)、bmolH2和cmolHI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的关系是________.
|
|
|
查看答案和解析>>
科目:
来源:海门市2007学年第一学期高三第一次诊断考试、化学试卷
题型:022
|
|
铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3=Cu(NO3)2+NO↑+NO2↑+H2O(未配平)
| (1) |
|
硝酸在该反应中的作用是________,该反应的还原产物是________.
|
|
(2) |
|
0.3molCu被硝酸完全溶解后,Cu失去的电子数是________,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是________,若用排水法收集这些气体,可得标准状况下的气体体积________.
|
|
(3) |
|
如果参加反应的Cu和HNO3的物质的量之比是5:14,写出并配平该反应的离子方程式________.
|
|
(4) |
|
如果没有对该反应中的某些物质的比例作限定,则方程式可能的配平系数有许多组.原因是________.
|
|
|
查看答案和解析>>
科目:
来源:海门市2007学年第一学期高三第一次诊断考试、化学试卷
题型:022
|
|
A、B、C、D四种元素都是短周期元素.A元素的离子焰色反应时火焰呈黄色.B元素的离子结构和Ne具有相同的电子层排布;5.8gB的氢氧化物恰好能与100mL2mol/L盐酸完全反应;B原子核中质子数和中子数相等.H2在C单质中燃烧产生苍白色火焰.D元素原子的电子层结构最外层电子数是次外层电子数的三倍.根据上述条件,回答:
| (1) |
|
C元素在元素周期表中的位置是________,它的最高价氧化物的化学式为________.
|
|
(2) |
|
C与B元素形成化合物的晶体类型是________.
|
|
(3) |
|
A与D形成稳定化合物的电子式为________,判断该化合物在空气是否变质的简易方法是________.
|
|
(4) |
|
C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为________.
|
|
|
查看答案和解析>>
科目:
来源:海门市2007学年第一学期高三第一次诊断考试、化学试卷
题型:022
|
|
利用如图所示的装置和其他必要的仪器用品,完成下列实验.

| (1) |
|
证明氨气具有还原性.已知2NH3+3CuO===N2+3Cu+3H2O.
①碱石灰的作用是________稀硫酸的作用是________.
②浓氨水与固体NaOH接触,为什么会逸出大量氨气?________.
③证明NH3具有还原性的实验现象是________.
|
|
(2) |
|
用吸收了足量氨气的硫酸溶液可以制取少量硫酸亚铁铵晶体.
已知:硫酸亚铁铵是淡蓝绿色晶体,在空气中性质比较稳定.硫酸亚铁铵在水中的溶解度小于硫酸铵、硫酸亚铁.制备硫酸亚铁铵的化学方程式为:
(NH4)2SO4+FeSO4+6H2O===(NH4)2Fe(SO4)2?H2O.
在烧杯中的溶液中加入稀H2SO4调节溶液至酸性;加入适量的硫酸亚铁浓溶液后,搅拌.为分离出硫酸亚铁铵晶体,还需要进行的实验操作是:________.
|
|
|
查看答案和解析>>
科目:
来源:海门市2007学年第一学期高三第一次诊断考试、化学试卷
题型:022
|
|
乙二酸(HOOC-COOH)俗称草酸,在生产和科学实验中有广泛的用途.
| (1) |
|
测定某未知浓度的KMnO4溶液,可用草酸作还原剂,估计需用0.50mol/L的草酸溶液90mL.则用草酸晶体(H2C2O4·2H2O)配制溶液时,所用的定量玻璃仪器是________(注明仪器规格);如果在定容时视线偏高,则所测得KMnO4溶液的浓度将________(填“偏大”、“偏小”或“不变”).滴定时的反应原理可简单表示为:H2C2O4+MnO4-→CO2↑+Mn2+则滴定终点时的颜色变化为:________.
|
|
(2) |
|
乙二酸其主要物理常数如下:

右图是教材上的一个实验装置图,观察装置判断进行该实验的目的是________,
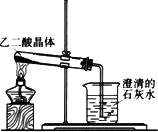
根据上述材料提供的信息,请指出该实验装置的不合理之处,说明理由.________.
|
|
|
查看答案和解析>>
科目:
来源:哈尔滨市第三中学2006-2007学年度高三年级上学期月考、化学试题
题型:022
|
|
磷是存在于自然界和生物体内的重要元素,回答下列问题:
| (1) |
|
磷在自然界里主要以化合态的形式存在于矿石中,磷的单质有多种同样异形体,其中最常见的是毒的________(填名称)和无毒的________(填名称).
|
|
(2) |
|
磷在不充足的氯气中燃烧的化学方程式是________.
|
|
(3) |
|
磷在空气中(设氧气在空气中的体积分数为20%)充分燃烧生成的氧化物通常可用作干燥剂.制备71g这种干燥剂所消耗的空气在标准状况下的体积约为________L.
|
|
|
查看答案和解析>>
科目:
来源:哈尔滨市第三中学2006-2007学年度高三年级上学期月考、化学试题
题型:022
常温下久置的纯净硝酸或浓硝酸往往显黄色,这是因为________,反应的化学方程式为________,这表现了硝酸的________性,消除其中的黄色最好的方法是________.
A、在光亮处放置
B、通入适量的空气
C、加入足量水
D、加入漂白粉
查看答案和解析>>
科目:
来源:哈尔滨市第三中学2006-2007学年度高三年级上学期月考、化学试题
题型:022
下列除杂试剂(括号内为杂质)正确的是________

查看答案和解析>>
