

科目: 来源: 题型:
【题目】A~J是初中化学中常见的物质,其中A为气体,B为红棕色粉末,E为浅绿色溶液,G是一种建筑材料,它们之间的关系如下图(部分反应物或生成物已略去)。

(1)写出化学式:D__________,I____________;
(2)A+B→C+D的化学反应方程式是_____________;
(3)F+I→G+J反应的基本类型为______________反应。
查看答案和解析>>
科目: 来源: 题型:
【题目】卓玛同学要用85g质量分数为10%的氢氧化钠溶液来制作“叶脉书签”,下图是她配制氢氧化钠溶液的实验操作示意图。
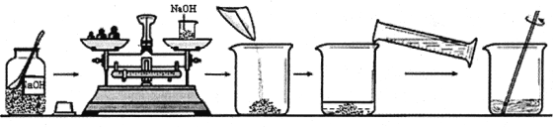
(1)卓玛同学配制该溶液时,需要称量____g氢氧化钠固体,应选择_____mL(填“10”、“50”或“100”)的量筒来量取所需水的体积(水的密度可近似看作1g/cm3)
(2)图中有一处操作有明显错误,该错误会导致所配制的氢氧化钠溶液的溶质质量分数_________(填“偏大”、“偏小”或“不变)。
查看答案和解析>>
科目: 来源: 题型:
【题目】有一包白色粉末,可能由CuSO4、Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种组成,同学们查阅资料得知NaCl、CaCl2、BaCl2等溶液呈中性,经过思考,设计并进行了以下实验:
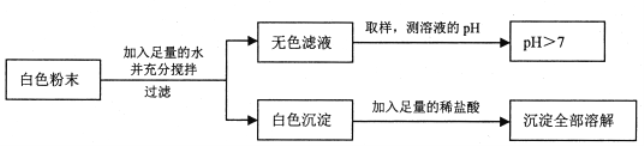
(1)白色粉末一定不含_____________,可能含有______________。
(2)为了确定白色粉末的组成,还需要对无色滤液中呈碱性的物质进行探究。
(提出问题)无色滤液中呈碱性的物质是什么?
(猜想假设)猜想一:NaOH
猜想二:______________
猜想三:Na2CO3和NaOH
(进行实验)
实验步骤 | 实验现象 | 结论 |
1.取少量该溶液于试管中 滴入_________溶液。 | _____________ | 猜想三正确 |
2.静置上述溶液,取少量上层清液于另一试管中,滴入几滴___________溶液。 | _______________ |
步骤1中发生反应的化学方程式为_______________。
(得出结论)白色粉末的成分是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】花青素(化学式为C15H11O6)具有缓解疲劳、保护视力的作用,该物质主要来源于各种蔬菜和水果,请回答下列问题:
(1)一个花青素分子中共有____________个原子;
(2)花青素分子中碳、氧元素的质量比为________________;
(3)花青素的相对分子质量为__________________;
(4)花青素中氧元素的质量分数为_________________。(计算结果精确到0.1%)
查看答案和解析>>
科目: 来源: 题型:
【题目】请根据下列装置图,回答有关问题:
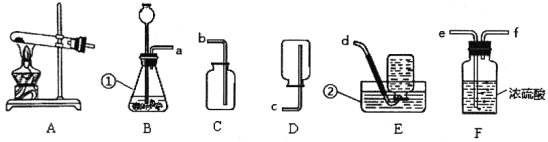
(1)写出图中标号仪器的名称:①___________②____________;
(2)写出用氯酸钾制取氧气的化学方程式______________________;
(3)做铁丝在氧气中燃烧的实验时,需要先打磨铁丝,目的是____________;
(4)用向上排空气法收集氧气时,验满的方法是_____________;
(5)实验室要干燥二氧化碳气体,气体应从F装置的_____________ (填“e”或“f”)管口通入。实验室制取二氧化碳的化学方程式为_____________;
(6)实验室用亚硫酸钠固体和浓硫酸反应制取二氧化硫,已知二氧化硫易溶于水,可在图中选用的发生装置和收集装置的组合是_________ (填字母)。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C三种固体物质的溶解度曲线如图所示,请回答下列问题:
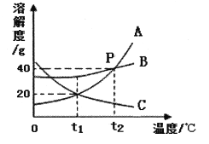
(1)P点的含义是_______________;
(2)要使接近饱和的C物质溶液变为饱和溶液,可采用的一种措施是_______________;
(3)t2℃时,B物质的饱和溶液中溶质与溶剂的质量比为___________;
(4)t1℃时,将50gA物质放入100g水中充分搅拌,所得溶液的溶质质量分数![]() (A)与同温下B物质饱和溶液的溶质质量分数
(A)与同温下B物质饱和溶液的溶质质量分数![]() (B)的大小关系为___(填序号)。
(B)的大小关系为___(填序号)。
①![]() (A)<
(A)<![]() (B)
(B)
②![]() (A)>
(A)>![]() (B)
(B)
③![]() (A)=
(A)=![]() (B)
(B)
④无法确定
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列粒子结构示意图回答问题:
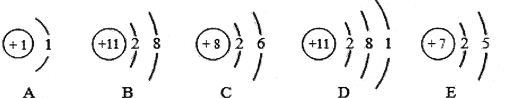
(1)A、B、C、D、E所示粒子共表示_____________种元素,其中C图所示的元素位于元素周期表的第____________周期;
(2)写出B图所示的粒子符号______________;
(3)由A、C两种元素组成化合物的化学式为_________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列图像不能正确反映其对应实验操作的是( )
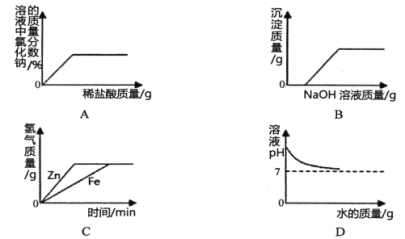
A. 向一定量NaOH溶液中滴加稀盐酸
B. 向H2SO4和CuSO4的混合溶液中滴加过量NaOH溶液
C. 向足量的锌粉、铁粉中分别加入等质量、等浓度的稀硫酸
D. 向氢氧化钠溶液中加入足量水
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列实验装置图,回答有关问题。
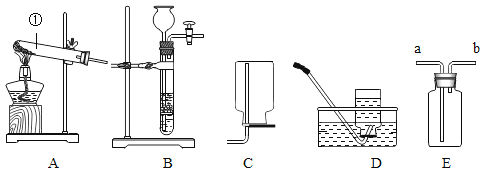
(1)图中标有①的仪器名称是______。
(2)实验室用氯酸钾和二氧化锰制取氧气,应选用的装置组合是______(填字母),反应的化学方程式为______,其中二氧化锰的作用是______。
(3)实验室用锌和稀硫酸制取氢气的化学方程式为______,用E装置收集氢气,气体应从______(填“a”或“b”)端通入。
(4)小强和小明两位同学对黄色的FeCl3溶液产生了浓厚的兴趣,查阅资料获得如下信息:
①FeCl3能与Cu、Fe、Al等金属反应生成FeCl2,如2FeCl3+Cu=2FeCl2+CuCl2;
②FeCl3溶液能使无色的苯酚溶液变成紫色。
(提出问题)①FeCl3溶液与金属铝反应有哪些现象?
②FeCl3溶液中的哪些粒子使苯酚溶液变成紫色?
(实验探究)取适量FeCl3溶液于试管中,进行如下实验:
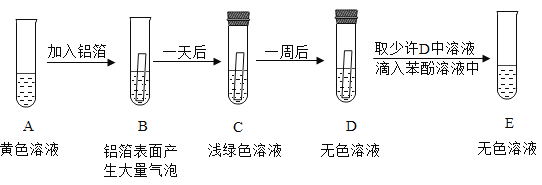
(思考与交流)
①实验前,铝箔表面需要进行打磨处理,其目的是______。
②FeCl3溶液的pH______7(填“>”、“<”或“=”)。
③溶液由黄色变成浅绿色的化学反应方程式为______。
④D中无色溶液的溶质是______(填化学式)。
⑤经分析,小强同学认为是Fe3+使苯酚溶液变成紫色,但小明同学认为若要得出此结论还需补做如下实验:在苯酚溶液中滴加稀盐酸,观察溶液是否变成紫色。小明的理由是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳酸钠广泛用于造纸、纺织、玻璃、洗涤剂、肥皂、制革等工业,是一种重要的化工原料。吕布兰、索尔维和侯德榜为碳酸钠的工业化生产作出了巨大贡献。
Ⅰ、吕布兰法
1789年,法国医生吕布兰(N.Leblanc,1742—1806)以食盐、浓硫酸,木炭和石灰石为原料,开创了规模化工业制取碳酸钠的先河,具体流程如下:

(1)碳酸钠俗称______。
(2)在高温条件下,②中发生两步反应,其中一步是Na2SO4和木炭生成Na2S和CO,该反应的化学方程式为______。
(3)③中“水浸”时通常需要搅拌,其目的是______。
(4)不断有科学家对吕布兰法进行改进,是因为此法有明显不足,请写出一条不足之处______。
Ⅱ、索尔维法
1892年,比利时工程师索尔维发明氨碱法制碳酸钠,又称索尔维法。原理如下:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl,2NaHCO3![]() Na2CO3+CO2↑+H2O。某兴趣小组采用下列装置模拟索尔维法制备碳酸氢钠,进而制得碳酸钠。
Na2CO3+CO2↑+H2O。某兴趣小组采用下列装置模拟索尔维法制备碳酸氢钠,进而制得碳酸钠。
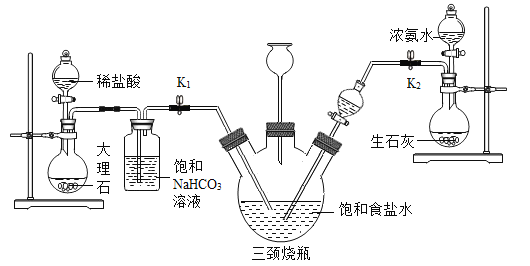
实验操作如下:
①关闭K1,打开K2通入NH3,调节气流速率,待其稳定后,打开K1通入CO2;
②待三颈烧瓶内出现较多固体时,关闭K2停止通NH3,一段时间后,关闭K1停止通CO2;
③将三颈烧瓶内的反应混合物过滤、洗涤、低温干燥,并将所得固体置于敞口容器中加热,记录剩余固体质量。
加热时间/min | t0 | t1 | t2 | t3 | t4 | t5 |
剩余固体质量/g | 未记录 | 15.3 | 13.7 | 11.9 | 10.6 | 10.6 |
请回答下列问题:
(5)饱和NaHCO3溶液的作用是除去CO2中混有的HCl,反应的化学方程式为______。
(6)三颈烧瓶上连接的长颈漏斗的主要作用是______,有同学认为应该在长颈漏斗内放置一团蘸有酸液的棉花,理由是______;关闭K2停止通NH3后,还要继续通一段时间
CO2,其目的是______。
(7)根据实验记录,计算t2时NaHCO3固体的分解率______(已分解的NaHCO3质量与加热前原NaHCO3质量的比值),请写出计算过程。若加热前NaHCO3固体中还存在少量NaCl,上述计算结果将_____(填“偏大”、“偏小”或“无影响”)。
(8)制碱技术在很长一段时间内把持在英、法等西方国家手中,我国化学工程专家侯德榜先生独立摸索出索尔维法并公布于众,又于1943年创造性地将制碱与制氨两种工艺联合起来,基本消除废弃物的排放,同时生产出碳酸钠和氯化铵两种产品,这就是著名的候氏制碱法。下列认识或理解正确的是______。
①科学认识是在曲折的、艰辛的积累过程中不断进步的;
②“科技兴邦、实业救国”是侯德榜先生回国研究的巨大动力;
③侯氏制碱法大大提高了原料的作用率,它符合当今“绿色化学”的理念。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com