
科目: 来源: 题型:
【题目】反应4A(s)+3B(g) ![]() 2C(g)+D(g),经2 min后,B的浓度减少了0.6 mol·L-1。对此反应速率的正确表示是( )
2C(g)+D(g),经2 min后,B的浓度减少了0.6 mol·L-1。对此反应速率的正确表示是( )
A. 用A表示的反应速率是0.8 mol·L-1·s-1
B. 在2 min末时的反应速率,用反应物B来表示是0.3 mol·L-1·min-1
C. 分别用B、C、D表示反应的速率,其比值是3∶2∶1
D. 在这2 min内用B和C表示的反应速率的值都是相同的
查看答案和解析>>
科目: 来源: 题型:
【题目】A是水煤气中的CO和H2按物质的量之比1∶2反应生成的惟一产物,F是由两种均具有芳香气味的有机物组成的混合物。相关物质转化关系如下:

(1)A的官能团的名称____,D的结构简式____。
(2)B→C的化学方程式是____。
(3)F的同分异构体中能与NaOH溶液反应的有____种(包括F自身)。
(4)下列说法正确的是____。
A 石油裂解气和B都能使酸性KMnO4褪色
B 可以用碳酸钠溶液洗去C、E和F混合物中的C、E
C 相同物质的量的D、E或F充分燃烧时消耗等量的氧气
D 有机物C和E都能与金属钠反应
查看答案和解析>>
科目: 来源: 题型:
【题目】目前,我国已经有上百个地区的加油站可提供标号为E90、E93的乙醇汽油,它们是在90#、93#汽油中加入了一定量的乙醇而制得。
(1)用玉米生产燃料乙醇的生产如下图表示:
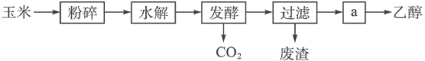
①粉碎玉米的目的是____。步骤a的操作是___。
②以玉米等淀粉原料生产乙醇的化学反应可用下式表示:
(C6H10O5)n+ nH2O![]() nC6H12O6
nC6H12O6
C6H12O6![]() 2C2H5OH + 2CO2↑
2C2H5OH + 2CO2↑
100 kg玉米淀粉最多可生产无水乙醇____kg。
(2)乙醇汽油在储存和运输过程中应特别注意防水。如果乙醇汽油中混入了水,可能出现______现象。
(3)常温下,1g乙醇完全燃烧释放29.71kJ热量,请写出乙醇完全燃烧的热化学方程式______。
(4)由玉米等农产品为原料制得的乙醇作燃料,是否是增加大气中CO2的含量,为什么?______。
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积固定的VL密闭容器中充入4molNH3和5molO2,发生如下反应:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g)。请回答下列问题:
4NO(g)+6H2O(g)。请回答下列问题:
(1)下列能说明该反应已经达到平衡状态的是_______;
A .容器中气体总质量不变
B. c(O2)不变
C. υ(O2)=1.25υ(NH3)
D. 体系压强不变
E. 相同时间内,消耗0.1 mol NH3,同时消耗了0.1 mol NO
(2)已知上述反应达到平衡后,该反应各物质的浓度的定量关系称之为K,其表达式可表示为K =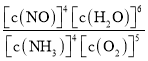 。如果达到平衡时,NH3的转化率为a,则K=_____(用含a的式子表示,数字采用指数形式)。
。如果达到平衡时,NH3的转化率为a,则K=_____(用含a的式子表示,数字采用指数形式)。
(3)若反应在绝热密闭系统中进行时,其余条件不变,反应速率是先增大后减小。则速率逐渐增大是因为______,速率又逐渐减小的原因是_____。
(4)1mol NH3(g)在纯氧中完全燃烧生成无污染的气态物质,放出akJ的热量。写出该反应的热化学方程式_____。
(5)若将(4)所述反应设计为原电池,负极反应式 ______。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应4NH3(g)+5O2(g)===4NO(g)+6H2O(g)在2 L密闭容器中进行1分钟后,NH3减少了0.12 mol,则平均每秒钟浓度变化正确的是( )
①NO:0.001 mol·L-1 ②H2O:0.002 mol·L-1
③NH3:0.002 mol·L-1 ④O2:0.001 25 mol·L-1
A. ①④ B. ②③ C. ③④ D. ①②
查看答案和解析>>
科目: 来源: 题型:
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快
查看答案和解析>>
科目: 来源: 题型:
【题目】设阿伏加德罗常数的数值为NA,下列说法正确的是
A. pH=3的硫酸溶液中所含H+的数目为10-3NA
B. 7.8g Na2O2与足量SO2完全反应,转移的电子数为0. 1NA
C. 标准状况下,11.2 L丙烷中含有的共用电子对数目为5NA
D. 0.1mol NH3与0.1 mol HC1在密闭容器中充分反应后,气体的分子总数为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醛被视为“空气杀手”,可用如下方法检测:5HCHO+4MnO4-+12H+==4Mn2++5CO2+11H2O。下列说法不正确的是
A. 甲醛中存在极性键
B. CO2的电子式为![]()
C. MnO4-是氧化剂,CO2是氧化产物
D. 当有1.8 g甲醛参加反应时,转移电子的物质的量为0.12mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com