
科目: 来源:平阳中学2006-2007学年度第一学期高三年级期中考试、化学试题 题型:022
| |||||||||||||||||||
查看答案和解析>>
科目: 来源:平阳中学2006-2007学年度第一学期高三年级期中考试、化学试题 题型:022
| |||||||||||||||||||
查看答案和解析>>
科目: 来源:平阳中学2006-2007学年度第一学期高三年级期中考试、化学试题 题型:022
| |||||||||||||||||||||||
查看答案和解析>>
科目: 来源:平阳中学2006-2007学年度第一学期高三年级期中考试、化学试题 题型:022
| |||||||||||||||||||
查看答案和解析>>
科目: 来源:南通中学2007届高三期中考试化学试卷 题型:022
阅读下列两段材料,请回答下列问题:
材料一:2006年全国理综I第9题:把分别盛有熔融的氯化钾、氯化镁、氯化铝的三个电解槽
串联,在一定条件下通电一段时是后,析出钾、镁、铝的物质的量之比为
A、1∶2∶3
B、3∶2∶1
C、6∶3∶1
D、6∶3∶2
材料二:已知下列表中有关物质的熔、沸点如下:
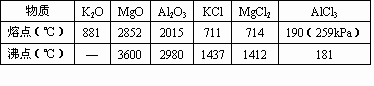
(1)有人认为材料一中的题干与选项有矛盾,若选项正确,则结合材料二可推知氯化钾、氯化镁、氯化铝三种物质中有一种物质是不符合题意的,这种物质是________其理由是________
(2)有人认为材料一中的题干正确,只要把一个正确的选项补加进去就是一道好题,你认为选项改加“(I)0:0:0”和“(II)6:3:0”哪个好?________填写编号)
(3)也有人认为只要把氯化钾、氯化镁、氯化铝中的其中一种物质改为材料二表格中另一种物质也符合题意.写出电解这种物质的化学方程式:________
(4)设计可靠实验证明:MgCl2、AlCl3所属的晶体类型,其实验方法是________.
查看答案和解析>>
科目: 来源:南通中学2007届高三期中考试化学试卷 题型:022
(1)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成,而是在反应物到生成物的过程中经过一个高能量的过渡态.图甲是白磷(P4)和O2反应生成P4O10过程中能量变化示意图,请写出白磷(P4)和O2反应生成P4O10的热化学方程式:________(△H用含E1和E2的代数式表示,其中E1、E2均大于0).
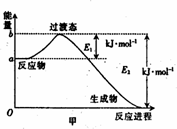
(2)白磷(图乙)是正四面体构型的分子,当与氧气作用形成P4O6时,相当于每两个磷原子之间插入一个氧原子(如图丙).当形成P4O10时,相当于在P4O6的分子中每个磷原子又以双键结合一个氧原子(如图丁).

请在图丙的示意图中把磷原子用钢笔或铅笔把磷原子涂黑.
(3)进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关.键能可以简单的理解为断开1mol化学键时所需吸收的能量.下表是部分化学键的键能数据:
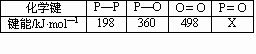
已知白磷(P4)的燃烧热为2982kJ·mol—1,白磷完全燃烧的产物结构如图丁所示,则上表中x=________
(4)写出1molP4与O2反应生成固态P4O6的反应热△H=________.
查看答案和解析>>
科目: 来源:南通中学2007届高三期中考试化学试卷 题型:022
| |||||||||||||||
查看答案和解析>>
科目: 来源:南通中学2007届高三期中考试化学试卷 题型:022
| |||||||||||||||
查看答案和解析>>
科目: 来源:南通中学2007届高三期中考试化学试卷 题型:022
| |||||||||||||||||||
查看答案和解析>>
科目: 来源:南通中学2007届高三期中考试化学试卷 题型:022
| |||||||||||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com