
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
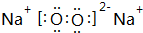 ,其中含有的化学键为离子键、共价键.
,其中含有的化学键为离子键、共价键.查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | 0 |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
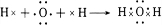 .
.查看答案和解析>>
科目: 来源: 题型:解答题
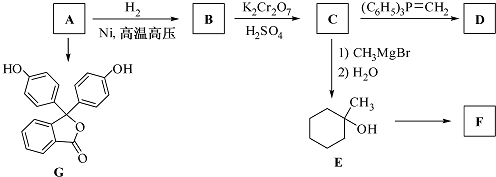
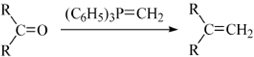
 .
.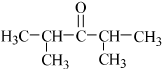 或
或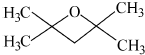 (任写一种).
(任写一种). .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 乙酸乙酯和水,酒精和水,苯酚和水 | |
| B. | 二溴乙烷和水,溴苯和水,硝基苯和水 | |
| C. | 甘油和水,乙醛和水,乙酸和乙醇 | |
| D. | 醋酸和水,甲苯和水,己烷和水 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3 mol•L-1氨水 | B. | 4 mol•L-1 HNO3 | ||
| C. | 8 mol•L-1 NaOH | D. | 18 mol•L-1 H2SO4 |
查看答案和解析>>
科目: 来源: 题型:解答题
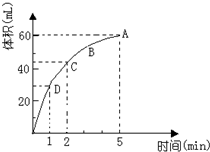 为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于 50mL密度为 1.1g/cm3的双氧水溶液中,通过实验测定:在标准状况下放
为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于 50mL密度为 1.1g/cm3的双氧水溶液中,通过实验测定:在标准状况下放查看答案和解析>>
科目: 来源: 题型:解答题
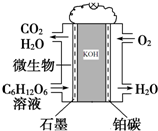 微生物燃料电池是利用微生物作为反应主体,将有机物的化学能转化为电能.如以葡萄糖溶液为例,其工作原理如图所示:
微生物燃料电池是利用微生物作为反应主体,将有机物的化学能转化为电能.如以葡萄糖溶液为例,其工作原理如图所示:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com