
科目: 来源: 题型:
| 汽油 | 乙醇 |
密度 | 0.7 g·cm-3 | 0.8 g·cm-3 |
燃烧热 | 5 518 kJ·mol-1 | 1 367 kJ·mol-1 |
(1)求每升乙醇汽油完全燃烧放出的热量。
(2)一辆百千米耗油10 L的汽车,改用乙醇汽油后百千米耗油多少升?
查看答案和解析>>
科目: 来源: 题型:

已知,D是醇类中分子相对质量最小的物质,F是醋酸的同系物;G的分子式为C4H6O2。
试完成下列问题:
(1)指出图中相关反应的反应类型:X____________、Y____________;
(2)写出高分子涂料Ⅰ的结构简式:Ⅰ____________;
(3)写出H的任意三种同分异构体的结构简式:____________、____________和____________(要求物质的类别不同);
(4)完成下列转化的化学方程式:

查看答案和解析>>
科目: 来源: 题型:

请按要求完成下列问题:
(1)D的电子式______________。
(2)写出化学式:C_________,E_________
(3)写出E与Y电解反应的离子方程式________________________。
(4)写出F与HCl反应的化学方程式___________________________________________。
(5)写出在F的溶液里通入CO2的离子方程式___________________________________。
查看答案和解析>>
科目: 来源: 题型:
气体 | A | B | C |
烧瓶和气体的总质量/g | 48.408 2 | 48.408 2 | 48.408 2 |
气体 | D | E | F |
烧瓶和气体的总质量/g | 48.382 2 | 48.434 2 | 48.876 2 |
已知标准状况下,烧瓶的容积为0.293 L,烧瓶和空气的总质量是48.421 2 g。空气的平均相对分子质量为29。A、B、C、D、E、F是中学常见的气体。
(1)上述六种气体中,能够使品红溶液褪色的是(写化学式)_______________________。
(2)E的相对分子质量是_____________________________________________。
(3)实验室制取少量D的化学方程式是__________________________________________。
(4)A、B、C可能的化学式是_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:

请完成下列问题:
(1)D是_____________,E_____________是,H是_____________。
(2)写出下面反应的离子方程式:
④是__________________________;⑤是__________________________。
查看答案和解析>>
科目: 来源: 题型:

请按要求完成下列问题:
(1)反应③的化学方程式__________________________________________________。
(2)C的结构式_______________;H的化学式_____________________。
(3)L的溶液与化合物E反应的离子方程式_______________________________________。
(4)化合物J的化学式________________________________。
查看答案和解析>>
科目: 来源: 题型:

下列说法正确的是
A.它们的一氯代物均只有三种
B.它们之间互为同系物
C.三星烷与乙苯互为同分异构体
D.六星烷的分子式为C18H24
查看答案和解析>>
科目: 来源: 题型:

(1)写出D的结构简式_______________________________________。
(2)写出B的结构简式_______________________________________。
(3)写出第②步反应的化学方程式___________________________________________。
(4)写出富马酸的一种相邻同系物的结构简式_________________________________。
(5)写出第⑨步反应的化学方程式_____________________________________________。
(6)以上反应中属于消去反应的是___________(填入编号)。
查看答案和解析>>
科目: 来源: 题型:

请按要求完成下列问题:
(1)写出B的化学式______________,G的电子式______________。
(2)反应①的离子方程式为____________________________________________。
(3)反应②进行的条件是______________、______________。
(4)反应③的化学方程式为________________________________________。
查看答案和解析>>
科目: 来源: 题型:
四种盐在不同温度下的溶解度(g/100 g水)表
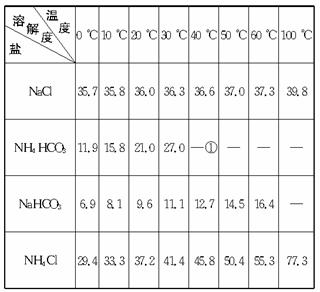
①>35 ℃NH4HCO3会有分解
请完成下列问题:
(1)反应温度控制在30—35 ℃,是因为若高于35 ℃,则_______________,若低于30 ℃,则_______________;为控制此温度范围,采取的加热方法为_______________。
(2)加料完毕后,继续保温30分钟,目的是_______________。静置后只析出NaHCO3晶体的原因是_______________。用蒸馏水洗涤NaHCO3晶体的目的是除去_______________杂质(以化学式表示)。
(3)过滤所得的母液中含有_______________(以化学式表示),需加入_______________,并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。
(4)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1—2滴酚酞指示剂,用物质的量浓度为c(mol·L-1)的HCl溶液滴定至溶液由红色到无色(指示![]() +H+====
+H+====![]() 反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=______________。
反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com