
科目: 来源: 题型:选择题
| A. | 无色透明的溶液中:HCO3-、K+、Na+、MnO4- | |
| B. | 酸性溶液中可能大量存在Na+、ClO-、SO42-、I- | |
| C. | 含有0.1 mol•L-1 Fe3+的溶液中可以大量存在:K+、Mg2+、I-、NO3- | |
| D. | 室温下,pH=l的溶液中一定可以存在:Na+、Fe3+、NO3-、SO42- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯气、SO2都能使品红溶液褪色,它们的漂白原理相同 | |
| B. | 滴加石蕊试液显红色的溶液:Fe3+、NH4+、I-可能大量共存 | |
| C. | 某溶液中加入盐酸酸化的氯化钡产生白色沉淀,原溶液中一定含有SO42- | |
| D. | Fe(NO3)2溶液中滴加少量稀硫酸会变黄色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 含有NA个氮原子的氮气在标准状况下的体积约为11.2L | |
| B. | 25℃,1.01×105Pa,64gSO2中含有的原子数小于3NA | |
| C. | 在常温常压下,11.2L Cl2含有的分子数为0.5NA | |
| D. | 1 mo1 Na2O2与足量H2O反应,转移了2 NA 个电子 |
查看答案和解析>>
科目: 来源: 题型:解答题
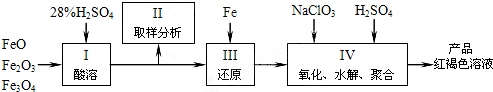
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E都含X元素,其转化关系如图所示.
常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E都含X元素,其转化关系如图所示.查看答案和解析>>
科目: 来源: 题型:填空题
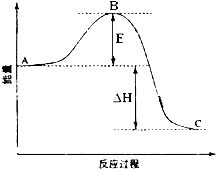 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:填空题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com