
科目: 来源: 题型:选择题
| A. | 食品保存在冰箱中不易坏,说明温度对反应速率有影响 | |
| B. | 在金属与非金属的分界线附近寻找半导体材料 | |
| C. | 在周期表中,第IA族全部为金属元素 | |
| D. | 金刚石与石墨互为同素异形体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 气态氢化物的热稳定性:H20>NH3 | |
| B. | 最高价氧化物对应水化物的酸性:H3PO4<H2SO4 | |
| C. | 原子半径:Na>Mg>Al | |
| D. | N元素的最高价氧化物对应的水化物和它的氢化物反应不能生成盐 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 锌粒与稀硫酸的反应 | |
| B. | 木炭燃烧 | |
| C. | 甲烷在空气中燃烧的反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
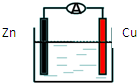
| A. | 锌做负极发生氧化反应 | |
| B. | 供电时的总反应为:Zn+2H+=Zn2++H2↑ | |
| C. | 该装置可实现化学能转化为电能 | |
| D. | 溶液中硫酸根离子向Cu极移动 |
查看答案和解析>>
科目: 来源: 题型:解答题
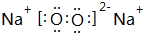 .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| ①将一小块金属钠放入滴有酚酞试液的冷水中 | 钠块浮在水面上,熔化成闪亮的小球,做不定向移动,随之消失,溶液变红色 |
| ②将表面积大致相同的镁条和铝条(均已用砂纸打磨过,分别投入足量的相同体积的0.5mol/L的盐酸中 | 镁条剧烈反应,迅速产生大量的无色气体,而铝条反应不十分剧烈,产生无色气体,镁条消失比铝条快 |
| ③将新制的氯水滴加到新制的Na2S溶液中 | |
| ④将相同质量的镁条(已用砂纸打磨过)和铝粉分别投入到足量的相同体积的0.5mol/L的盐酸和3mol/L的盐酸中 | 剧烈反应产生气体,但铝粉消失比镁条快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com