
科目: 来源: 题型:选择题
| A. | 铍(Be)的原子失电子能力比镁弱 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 氢氧化锶[Sr(OH)2]比氢氧化钙的碱性强 | |
| D. | 硒(Se)化氢比硫化氢稳定 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性 | 1.0 | 1.5 | 2.0 | 2.5 | 3.5 | 4.0 | 0.9 | 1.5 | 1.8 | 2.1 | 2.5 | 3.1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | (O2)=0.01mol/(L•s) | B. | (NO)=0.08mol/(L•s) | ||
| C. | (H2O)=0.0013mol/(L•s) | D. | (NH3)=0.002mol/(L•s) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极得电子反应产物是Mn2O3(s) | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 外电路中每通过O.2mol电子,锌的质量理论上减小6.5g |
查看答案和解析>>
科目: 来源: 题型:解答题
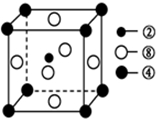
 现有10种元素的性质、数据如下表所列,它们均为短周期元素.
现有10种元素的性质、数据如下表所列,它们均为短周期元素.| A | B | C | D | E | F | G | H | I | J | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
| 最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
| -2 | -3 | -1 | -3 | -2 |
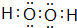 ,构成该物质的化学键类型有极性键和非极性键;画出A与B形成化合物的形成过程表示式:
,构成该物质的化学键类型有极性键和非极性键;画出A与B形成化合物的形成过程表示式: _.
_.
查看答案和解析>>
科目: 来源: 题型:解答题
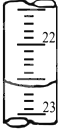 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:| 滴定次数 | 待测液 体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 4.00 | 24.00 |
| 第三次 | 20.00 | 2.00 | 24.10 |
查看答案和解析>>
科目: 来源: 题型:解答题
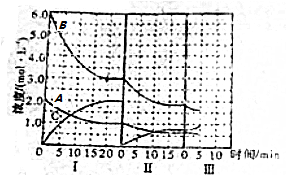
查看答案和解析>>
科目: 来源: 题型:解答题
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.00 | 19.90 |
| 第二次 | 25.00 | 0.00 | 20.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
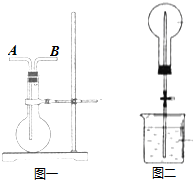
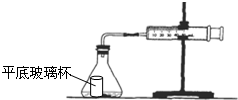 盐酸与碳酸钙反应生成CO2,运用如图,通过测量一定时间内产生CO2气体的体积,可测定该反应的速率.室温是29.5℃.请根据要求填空:
盐酸与碳酸钙反应生成CO2,运用如图,通过测量一定时间内产生CO2气体的体积,可测定该反应的速率.室温是29.5℃.请根据要求填空:| 时间/s | 10 | 20 | 30 | 40 | 50 | 60 |
| 气体体积/mL | 4 | 14 | 25 | 38 | 47 | 55 |
| 反应速率/mL•s-1 | 0.4 | 1.0 | 1.1 | 1.3 | 0.9 | 0.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com