
科目: 来源: 题型:选择题
| A. | 用pH计、电导率仪(一种测量溶液导电能力的仪器)均可监测乙酸乙酯的水解程度 | |
| B. | 金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理 | |
| C. | 邻苯二甲酸氢钾可用于标定NaOH溶液的浓度,假如称量邻苯二甲酸氢钾时电子天平读数比实际质量偏大,则测得的NaOH溶液浓度比实际浓度偏小 | |
| D. | 高锰酸钾是一种常用的化学试剂,当高锰酸钾晶体结块时,应在研钵中用力研磨,以得到细小晶体,有利于加快反应或溶解的速率 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 丁烷 | B. | 乙烷 | C. | 甲烷 | D. | 丙烷 |
查看答案和解析>>
科目: 来源: 题型:解答题
 已知A,B,C,D,E五种元素的原子序数依次递增,A,B,C,D位于前三周期,A位于周期表的s区,其原子中电子层数和和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A,B,C,D,E五种元素的原子序数依次递增,A,B,C,D位于前三周期,A位于周期表的s区,其原子中电子层数和和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲醇 | B. | 乙二醇 | C. | 异丙醇 | D. | 甘油 |
查看答案和解析>>
科目: 来源: 题型:填空题
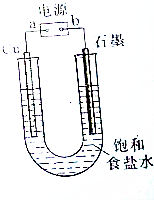 用如图所示装置电解饱和食盐水制Cl2、H2和NaOH.
用如图所示装置电解饱和食盐水制Cl2、H2和NaOH.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1mol•L-1的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| B. | 0.1 mol•L-1 NaHS溶液中:c(H2S)+c(H+)=c(OH-)+c(S2-) | |
| C. | 将pH=2的盐酸和pH=12的氨水等体积混合后的溶液中:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | 0.1 mol•L-1 NH4HSO4溶液与0.1 mol•L-1 NaOH溶液等体积混合后的溶液中:c(Na+)>c(NH4+)>c(SO42-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com