相关习题
0 95439 95447 95453 95457 95463 95465 95469 95475 95477 95483 95489 95493 95495 95499 95505 95507 95513 95517 95519 95523 95525 95529 95531 95533 95534 95535 95537 95538 95539 95541 95543 95547 95549 95553 95555 95559 95565 95567 95573 95577 95579 95583 95589 95595 95597 95603 95607 95609 95615 95619 95625 95633 203614
科目:
来源:英德中学2007届高三化学第二轮复习专题强化训练7
题型:022
|
|
中学化学中有很多物质可以实现下图中物质之间的转化.其中反应条件和部分反应的产物已略去.液体B和C可能是单一溶质的溶液,也可能是纯净物.
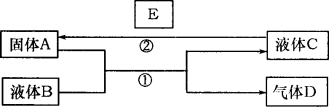
| (1) |
|
若A是一种紫红色金属,气体D能使品红溶液褪色,加热时又恢复原色.写出反应①的化学方程式________该气体D与另一种气体H混合后生成一种淡黄色固体w,写出该反应的化学方程式________
|
|
(2) |
|
若A是一种金属单质,D是最轻的气体,B能否是NaOH溶液________(填“能”、“否”).
|
|
(3) |
|
若A是金属单质,D是一种无色气体,遇到空气变为红棕色,液体C呈蓝色.写出反应①的离子方程式________写出反应②的任意一个离子方程式________
|
|
|
查看答案和解析>>
科目:
来源:英德中学2007届高三化学第二复习专题强化训练5
题型:022
|
|
蓄电池是一种可以反复充电、放电的装置.有一种蓄电池在充电和放电时发生的反应是:NiO2+Fe+2H2O Fe(OH)2+Ni(OH)2 Fe(OH)2+Ni(OH)2
| (1) |
|
若此蓄电池放电时,该电池某一电极发生还原反应的物质是
|
| [ ] |
A. |
NiO2
|
B. |
Fe
|
C. |
Fe(OH)2
|
D. |
Ni(OH)2
|
|
(2) |
|
假如用此蓄电池分别用来电解以下两种溶液,工作一段时间后都分别消耗0.36 g水,且电解池的电极均为惰性电极,试回答下列问题.
①电解M(NO3)x溶液时某一极增加了ag M,则金属M的相对原子质量的计算式为________(用“a、x表示).
②电解含有0.01 mol CuSO4和0.0l mol NaCl的混合溶液l00 mL,阳极产生标准状况气体________L;将电解后溶液加水稀释至1 L,此时溶液的pH=_________
|
|
|
查看答案和解析>>
科目:
来源:英德中学2007届高三化学第二复习专题强化训练5
题型:022
|
|
某温度(T℃)下的溶液中,c(H+)=10-x mol·L-1,c(OH-)=10-y mol·L-1,x与y的关系如下图所示,请回答下列问题:
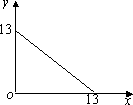
| (1) |
|
此温度下,水的离子积Kw为________,则该温度T________25℃(填“>”、“<”或“=”),pH=7的溶液显________(填“酸”、“碱”或“中”)性.
|
|
(2) |
|
若将此温度(T℃)下,pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(假设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比.
①若所得混合液为中性,则a∶b=________;
②若所得混合液的pH=2,则a∶b=________.
|
|
|
查看答案和解析>>
科目:
来源:英德中学2007届高三化学第二复习专题强化训练5
题型:022
|
|
现有常温下的0.1 mol·L-1纯碱溶液.
| (1) |
|
你认为该溶液呈碱性的原因是(用离子方程式表示):________为证明你的上述观点,请设计一个简单的实验,简述实验过程:________
|
|
(2) |
|
同学甲认为该溶液中Na2CO3的水解是微弱的,发生水解的 离子不超过其总量的10%.请你设计实验证明该同学的观点是否正确.________ 离子不超过其总量的10%.请你设计实验证明该同学的观点是否正确.________
|
|
(3) |
|
同学乙就该溶液中粒子之间的关系写出了下列四个关系式,你认为其中正确的是
|
A. |
c(Na+)=2c( ) )
|
B. |
c( )>c(OH-)>c( )>c(OH-)>c( )>c(H2CO3) )>c(H2CO3)
|
C. |
c( )+c( )+c( )=0.1 mol·L-1 )=0.1 mol·L-1
|
D. |
c(OH-)=c(H+)+c( )+2c(H2CO3) )+2c(H2CO3)
|
|
(4) |
|
水解反应是典型的可逆反应.水解反应的化学平衡常数称为水解常数(用Kh表示),请写出Na2CO3第一步水解反应的水解常数的表示式:________
|
|
|
查看答案和解析>>
科目:
来源:英德中学2007届高三化学第二复习专题强化训练5
题型:022
|
|
现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:
| (1) |
|
取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________ 移动(填“向左”、“向右”或“不”);另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将(填“增大”、“减小”或“无法确定”).________.
|
|
(2) |
|
相同条件下,取等体积的甲、乙两溶液,各稀释100倍.稀释后的溶液,其pH大小关系为:pH(甲)________pH(乙)(填“大于”、“小于”或“等于”).
|
|
(3) |
|
各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲)_______V(乙)(填“大于”、“小于”或“等于”).
|
|
(4) |
|
取25 mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为:c(Na+)________c(CH3COO-)(填“大于”、“小于”或“等于”).
|
|
|
查看答案和解析>>
科目:
来源:英德中学2007届高三化学第二复习专题强化训练3
题型:022
|
|
元素周期表反映了元素性质的周期性变化规律.请根据短周期元素在周期表中的位置、结构和相关性质,回答下列问题:
| (1) |
|
短周期元素中,原子最外层电子数和电子层数相等的元素有________种.
|
|
(2) |
|
第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如下表所示,
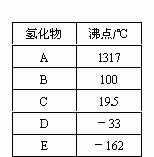
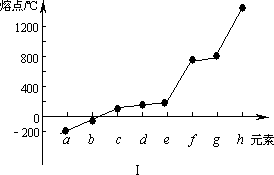
其中C的化学式为________;第三周期元素单质的熔点(℃)变化如下图I所示,其中h的元素符号为________.
|
|
(3) |
|
原子半径最小的元素与第二周期的两种元素可分别形成分子甲和离子乙.分子甲和离子乙含有相等的电子数,且乙的立体结构如图Ⅱ所示.请写出甲、乙反应的离子方程式________.
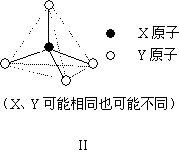
|
|
(4) |
|
第二、第三周期的某些元素中能形成具有图Ⅱ所示的结构单元的单质丙和化合物丁,丙和丁的晶体类型相同,且丙与丁在高温时能发生置换反应.若该反应中丙被破坏了1 mol共价键,则参加反应的丁的质量为________g.
|
|
|
查看答案和解析>>
科目:
来源:英德中学2007届高三化学第二复习专题强化训练3
题型:022
|
|
A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题:
| (1) |
|
常温下,X、Y的水溶液的pH均为5.则两种水溶液中由水电离出的H+浓度之比是________.
|
|
(2) |
|
A、B、D、E四种元素组成的某无机化合物,受热易分解.写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式________.
|
|
(3) |
|
将铝片和镁片用导线相连,插入由A、D、E三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为________
|
|
|
查看答案和解析>>
科目:
来源:英德中学2007届高三化学第二复习专题强化训练3
题型:022
|
|
A、B、C三种元素都是短周期元素,它们的原子核外电子层数相同.A、B元素各自形成的A离子和B离子均和Ne元素的原子电子层结构相同,A元素的氢氧化物比B元素的氢氧化物碱性强.5.8 g B的氢氧化物恰好能与100 mL 2 mol/L盐酸完全反应.C元素的单质化学性质活泼但不能直接和氧气反应.根据上述条件,回答下列问题:
| (1) |
|
A元素和C元素形成化合物的晶体类型是________晶体.
|
|
(2) |
|
C元素在元素周期表中的位置是________;C的最高价氧化物的分子式为________.
|
|
(3) |
|
B的氢氧化物与盐酸反应的离子方程式:________.
|
|
(4) |
|
C元素的单质,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为________.
|
|
|
查看答案和解析>>
科目:
来源:英德中学2007届高三化学第二复习专题强化训练1
题型:022
|
|
能源是人类社会发展进步的物质基础,在当代,能源、信息、材料一起构成了现代文明的三大支柱.
| (1) |
|
为了降低汽车尾气对大气的污染,有关部门拟用甲醇替代液化石油气作为公交车的燃料.已知:在25℃10 kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68 kJ.请写出表示甲醇燃烧的热化学方程式:________.
|
|
(2) |
|
测定工业甲醇中CH3OH的质量分数可按下法:取0.100 g工业甲醇样品,以适量H2SO4酸化后,加入20.00 mL 0.200 mol·L-1的K2Cr2O7溶液,再用0.3000 mol·L-1 (NH4)2Fe(SO4)2标准溶液滴定,耗去此标准液20.200 mL时,刚好到达滴定终点.已知:CH3OH+Cr2O72-+8H+CO2↑+2Cr3++6H2O
①写出H2SO4酸化的K2Cr2O7溶液与(NH4)2Fe(SO4)2溶液反应的离子方程式.
________.
②盛装(NH4)2Fe(SO4)2标准溶液的应为________(“酸式”或“碱式”)滴定管.如果达滴定终点时,仰视读数,则读数偏________.(“大”或“小”)
③此工业甲醇中CH3OH的质量分数________.
|
|
|
查看答案和解析>>
科目:
来源:英德中学2007届高三化学第二复习专题强化训练1
题型:022
|
|
铜是人类最早熟悉的金属之一,埋藏在地下的青铜器锈蚀过程中形成一系列难溶性的铜的化合物,锈蚀过程可以表示为:
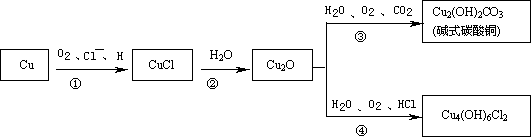
| (1) |
|
Cu2O的颜色为________,Cu4(OH)6Cl2的名称为________
|
|
(2) |
|
青铜器出土后,防止青铜器继续锈蚀的关键是________
|
|
(3) |
|
(4) |
|
|
查看答案和解析>>
