
科目: 来源: 题型:解答题
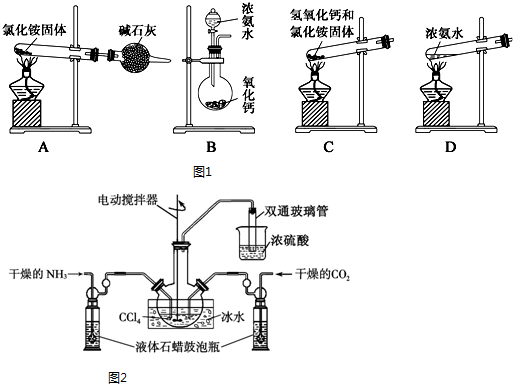
查看答案和解析>>
科目: 来源: 题型:选择题
| 元素符号 | 元素性质或原子结构 |
| T | M层上的电子数是原子核外电子层数的2倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
| A. | 14X可用与测定文物年代 | B. | Z的非金属性比T强 | ||
| C. | Y和T位于同一主族 | D. | X元素形成的化合物种类很多 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 4:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用钢瓶储存液氯或浓硫酸 | |
| B. | 通过灼热的铜网以除去H2中混有的O2 | |
| C. | Cu与浓硫酸反应终止后,冷却,向试管中加适量蒸馏水以观察水合铜离子的颜色 | |
| D. | pH小于7的雨水即为酸雨 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
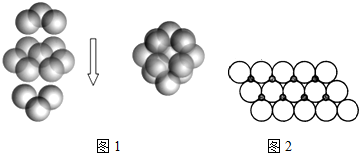
查看答案和解析>>
科目: 来源: 题型:解答题
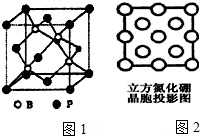 由N、B等元素组成的新型材料有着广泛用途.
由N、B等元素组成的新型材料有着广泛用途.查看答案和解析>>
科目: 来源: 题型:解答题
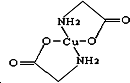 Cu及其化合物在科学研究和工业生产中具有许多用途.请回答以下问题:
Cu及其化合物在科学研究和工业生产中具有许多用途.请回答以下问题:查看答案和解析>>
科目: 来源: 题型:解答题
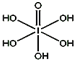 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com