
科目: 来源: 题型:解答题
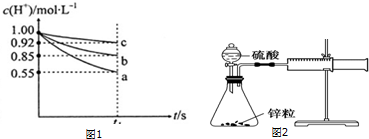
| 序号 | 加入的稀硫酸浓度 | 反应时间/min | 收集的气体/mL | 反应速率mL•min-1 |
| ① | 1mol•L-1 | 11 | 10 | |
| ② | 2mol•L-1 | a | 10 | b |
| ③ | 4mol•L-1 | 10 | 5.0 |
查看答案和解析>>
科目: 来源: 题型:解答题
 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
查看答案和解析>>
科目: 来源: 题型:解答题
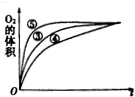 某实验小组以H2O2的分解为例,研究反应物浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2的分解为例,研究反应物浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.| 分 组 实 验 | 催化剂 | |
| ① | 10mL 5%的H2O2溶液 | 无 |
| ② | 10mL 2%的H2O2溶液 | 无 |
| ③ | 10mL 5%的H2O2溶液 | 1mL 0.1mol/L的FeCl3溶液 |
| ④ | 10mL 5%的H2O2溶液+少量盐酸 | 1mL 0.1mol/L的FeCl3溶液 |
| ⑤ | 10mL 5%的H2O2溶液+少量NaOH溶液 | 1mL 0.1mol/L的FeCl3溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 质子数为1.8NA | B. | 分子数为0.1NA | C. | 中子数为2NA | D. | 原子数为2.5NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | “青篙一握,以水二升渍,绞取汁”,该过程是对青篙素的提取,属于化学变化 | |
| B. | 向漂白粉溶液中滴加少量醋酸,漂白速率会加快 | |
| C. | 利用生物方法脱除生活污水中的氮和磷,可防止水体富营养化 | |
| D. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 |
查看答案和解析>>
科目: 来源: 题型:解答题
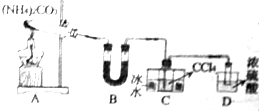 尿素(H2NCONH2)是一种非常重要的高氮化肥,同时也具有重要的工业用途.
尿素(H2NCONH2)是一种非常重要的高氮化肥,同时也具有重要的工业用途.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3.6g | B. | 1.8g | C. | 7.2g | D. | 4.8g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com