
科目: 来源: 题型:选择题
| A. | 二氧化硫与氢氧化钠溶液反应 | B. | 钠与氧气的反应 | ||
| C. | 铁在硫蒸气中燃烧 | D. | 铁粉加入硝酸中 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO2通入饱和Na2CO3溶液中 | B. | SO2通入CaCl2溶液中 | ||
| C. | NH3通入HNO3和AgNO3的混和溶液中 | D. | SO2通入Na2S溶液中 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 大量使用化肥和农药,能不断提高农作物产量 | |
| B. | 开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理 | |
| C. | 通过有机合成,可以制造出比钢铁更强韧的新型材料 | |
| D. | 安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | K2Cr2O7溶液 | Cr(OH)3 | Cr3+溶液 |
| 颜色 | 橙黄色 | 灰绿色沉淀 | 灰绿色 |
| Fe(OH)3 | Cr(OH)3 | |
| 开始沉淀时 | 1.5 | 6.0 |
| 沉淀完全时 | 2.8 | 8.0 |
| 实验 序号 | 实验装置 | 实验电压 | 溶液 | 时间 | 现象 |
| Ⅰ |  | 22V | 0.01mol/L K2Cr2O7溶液 | 20 分钟 | a 极区无明显现象; b 极区有无色气泡. |
| 实验 序号 | 实验装置 | 实验电压 | 溶液 | 时间 | 现象 |
| Ⅱ |  | 22V | 0.01mol/LK2Cr2O7溶液中加入少量H2SO4酸 化,使pH≈1 | 20 分钟 | a 极区溶液变浅绿色; b极区有无色气泡产生,产生红褐色沉淀. |
查看答案和解析>>
科目: 来源: 题型:解答题
 Li2CO3+Li2SiO3;该反应为放(填“吸”或者“放”)热反应,原因是升高温度,平衡向逆向进行,说明逆反应为吸热反应,所以正反应为放热反应.
Li2CO3+Li2SiO3;该反应为放(填“吸”或者“放”)热反应,原因是升高温度,平衡向逆向进行,说明逆反应为吸热反应,所以正反应为放热反应.
查看答案和解析>>
科目: 来源: 题型:选择题
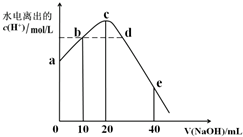
| A. | 从a到c,醋酸的电离始终受到促进 | |
| B. | a、d对应的纵坐标数值分别是:>10-12、>10-7 | |
| C. | b点:2c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| D. | 从b→c的过程中,既存在着pH=7的点,也存在着溶液中水所电离出的c(H+)=10-7的点 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 序号 | 操作及现象 | 结论 |
| A | 向溴水中加入少量苯,振荡静置后水层为无色 | 苯与Br2发生了加成反应 |
| B | 向某无色溶液中滴加硝酸酸化的BaCl2溶液,产生白色沉淀 | 原溶液中一定含有SO42- |
| C | 向25mL冷水和沸水中分别滴入5滴FeCl3饱和溶液,前者为黄色,后者为红褐色 | 温度升高,Fe3+的水解程度增大 |
| D | 将1mL KSCN溶液与1mL 同浓度FeCl3溶液充分混合;再继续加入KSCN溶液,溶液颜色加深 | 证明溶液中存在平衡:Fe3++3SCN?Fe(SCN)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 麦芽糖及其水解产物均能发生银镜反应 | |
| B. | 饱和硫酸铵和醋酸铅溶液均能使鸡蛋清溶液发生变性 | |
| C. | 油脂、二肽发生水解反应均可能得到含羧基的物质 | |
| D. | 天然橡胶 和杜仲胶 和杜仲胶 的单体是同种物质 的单体是同种物质 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向饱和CaCl2溶液中通入少量的CO2:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| B. | 向碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-═CO32-+H2O | |
| C. | 向Cu粉中加入过量的浓HNO3:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 氯化铵溶液显酸性的原因:NH4++OH-=NH3•H2O+H+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Z的氢化物是同主族简单氢化物中最稳定的 | |
| B. | 非金属性:Z>Y>X | |
| C. | XY2中各原子最外层均满足8电子结构 | |
| D. | X、Y的最高价氧化物对应的水化物酸性后者强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com